بخش های سایت
انتخاب سردبیر:
- مارک افسوس. سخنانی از کتاب مقدس، اعمال شوراها و سنت. پدران، که روح القدس فقط از پدر می آید، اما نه از پسر. تفاسیر در In
- بانوی ما برای کسانی که قسم می خورند دعا نمی کند
- • صلیب ایمان قدیم چه تفاوتی با صلیب ارتدکس دارد؟
- الفبای روسی را با حروف بزرگ چاپ کنید و روی یک برگه چاپ کنید
- نشان لیاقت نظامی
- تسخیر Perekop توسط ارتش سرخ
- معنی Boretsk marfa در یک دایره المعارف مختصر زندگینامه
- رئیس هیئت مدیره Belarusbank Viktor Ananich در مورد مسائل همکاری بیشتر با مدیریت Belaruskali Board Belarusbank JSB گفتگو کرد.
- اگر در خواب خواب ببینید چه تعبیری دارد؟
- خشکسالی، سونامی، اقیانوس اطلس - مد برای بلایای آب فایل xml آب برای gta 5
تبلیغات
| فرضیه های بور. مدل سیاره ای اتم رابطه بین انرژی و گشتاور |
|
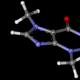
این چیه؟این مدل اتم رادرفورد است. این نام به افتخار فیزیکدان بریتانیایی متولد نیوزیلند، ارنست رادرفورد، که کشف هسته را در سال 1911 اعلام کرد، گرفته شده است. او در طی آزمایشهای خود بر روی پراکندگی ذرات آلفا بر روی ورق فلزی نازک، دریافت که بیشتر ذرات آلفا مستقیماً از فویل عبور میکنند، اما برخی از آنها منعکس میشوند. رادرفورد پیشنهاد کرد که در ناحیه کوچکی که از آن جهش کردند هسته ای با بار مثبت وجود دارد. این مشاهدات او را به تشریح ساختار اتم سوق داد که با اصلاحات در نظریه کوانتومی، امروزه هنوز پذیرفته شده است. همانطور که زمین به دور خورشید میچرخد، بار الکتریکی اتم در هسته متمرکز میشود که الکترونهایی با بار مخالف به دور آن میچرخند و میدان الکترومغناطیسی الکترونها را در مدار دور هسته نگه میدارد. به همین دلیل است که این مدل سیاره ای نامیده می شود. قبل از رادرفورد، مدل دیگری از اتم وجود داشت - مدل ماده تامپسون. این هسته نداشت، یک "کاپ کیک" با بار مثبت بود که پر از "کشمش" بود - الکترون هایی که آزادانه در آن می چرخیدند. به هر حال، این تامپسون بود که الکترون ها را کشف کرد. در مدرسه مدرنوقتی شروع به آشنایی می کنند، همیشه با این مدل شروع می کنند. رادرفورد (چپ) و تامپسون (راست) مدل های اتم //wikimedia.org مدل کوانتومی که امروزه ساختار اتم را توصیف می کند، البته با مدلی که رادرفورد ارائه کرد، متفاوت است. مکانیک کوانتومی در حرکت سیارات به دور خورشید وجود ندارد، اما مکانیک کوانتومی در حرکت الکترون به دور هسته وجود دارد. با این حال، مفهوم مدار هنوز در نظریه ساختار اتمی باقی مانده است. اما پس از اینکه مشخص شد که مدارها کوانتیزه شده اند، یعنی هیچ گذار مداومی بین آنها وجود ندارد، همانطور که رادرفورد فکر می کرد، نامیدن چنین مدلی سیاره ای نادرست شد. رادرفورد اولین گام را در مسیر درست برداشت و توسعه نظریه ساختار اتمی مسیری را که او ترسیم کرد دنبال کرد. چرا این برای علم جالب است؟آزمایش رادرفورد هسته ها را کشف کرد. اما هر آنچه در مورد آنها می دانیم بعداً آموختیم. نظریه او در طول چندین دهه توسعه یافته است و حاوی پاسخ هایی به سؤالات اساسی در مورد ساختار ماده است. پارادوکس ها به سرعت در مدل رادرفورد کشف شدند، یعنی: اگر یک الکترون باردار به دور یک هسته بچرخد، باید انرژی بتابد. می دانیم که جسمی که در یک دایره با سرعت ثابت حرکت می کند همچنان شتاب می گیرد زیرا بردار سرعت همیشه می چرخد. و اگر یک ذره باردار با شتاب حرکت کند، باید انرژی ساطع کند. این بدان معنی است که او تقریباً باید فوراً همه آن را از دست بدهد و به هسته بیفتد. بنابراین، مدل کلاسیک اتم به طور کامل با خود موافق نیست. سپس نظریه های فیزیکی شروع به ظهور کردند که سعی در غلبه بر این تناقض داشتند. افزودنی مهم به مدل ساختار اتمی توسط نیلز بور ساخته شد. او کشف کرد که چندین مدار کوانتومی به دور یک اتم وجود دارد که الکترون در آن حرکت می کند. او پیشنهاد کرد که الکترون همیشه انرژی ساطع نمی کند، بلکه فقط زمانی که از یک مدار به مدار دیگر حرکت می کند.
مدل اتم بور //wikimedia.org و پس از مدل بور اتم، اصل عدم قطعیت هایزنبرگ ظاهر شد، که در نهایت توضیح داد که چرا سقوط یک الکترون بر روی یک هسته غیرممکن است. هایزنبرگ کشف کرد که در یک اتم برانگیخته، الکترون در مدارهای دور قرار دارد و در لحظه ای که فوتون ساطع می کند، به مدار اصلی می افتد و انرژی خود را از دست می دهد. اتم وارد حالت پایداری می شود که در آن الکترون به دور هسته می چرخد تا زمانی که هیچ چیز از بیرون آن را تحریک نکند. این یک حالت پایدار است که الکترون فراتر از آن سقوط نخواهد کرد. با توجه به اینکه حالت پایه اتم یک حالت پایدار است، ماده وجود دارد، همه ما وجود داریم. بدون مکانیک کوانتومی، ما اصلاً ماده پایداری نخواهیم داشت. از این نظر، سوال اصلی که ممکن است یک فرد عادی از مکانیک کوانتومی بپرسد این است که چرا همه چیز اصلا سقوط نمی کند؟ چرا همه مواد به یک نقطه همگرا نمی شوند؟ و مکانیک کوانتومی می تواند به این سوال پاسخ دهد. چرا این را می دانید؟به یک معنا، آزمایش رادرفورد با کشف کوارک ها دوباره تکرار شد. رادرفورد کشف کرد که بارهای مثبت - پروتون ها - در هسته ها متمرکز شده اند. داخل پروتون ها چیست؟ اکنون می دانیم که کوارک ها در داخل پروتون ها وجود دارند. ما این را با انجام آزمایش مشابهی در مورد پراکندگی عمیق الکترون-پروتون غیرالاستیک در سال 1967 در SLAC (آزمایشگاه ملی شتاب دهنده، ایالات متحده آمریکا) آموختیم. این آزمایش بر اساس همان اصل آزمایش رادرفورد انجام شد. سپس ذرات آلفا سقوط کردند و در اینجا الکترون ها روی پروتون ها افتادند. در نتیجه برخورد، پروتونها میتوانند پروتون باقی بمانند یا به دلیل انرژی زیاد برانگیخته شوند و سپس وقتی پروتونها پراکنده میشوند، ذرات دیگر، برای مثال پی مزونها، میتوانند متولد شوند. معلوم شد که این مقطع طوری رفتار می کند که گویی اجزای نقطه ای در داخل پروتون ها وجود دارد. اکنون می دانیم که این اجزای نقطه ای کوارک هستند. به یک معنا، این تجربه رادرفورد بود، اما در سطح بعدی. از سال 1967، ما در حال حاضر یک مدل کوارک داریم. اما نمی دانیم در ادامه چه اتفاقی خواهد افتاد. اکنون باید چیزی را روی کوارک ها پراکنده کنید و ببینید که آنها به چه چیزی متلاشی می شوند. اما این مرحله بعدی است، تا کنون نمی توان این کار را انجام داد. علاوه بر این، مهمترین داستان از تاریخ علم روسیه با نام رادرفورد مرتبط است. پیوتر لئونیدوویچ کاپیتسا در آزمایشگاه خود کار می کرد. در اوایل دهه 1930، وی از خروج از کشور منع شد و مجبور شد در اتحاد جماهیر شوروی بماند. رادرفورد پس از اطلاع از این موضوع، تمام ابزارهایی را که در انگلستان داشت به کاپیتسا فرستاد و به این ترتیب به ایجاد موسسه مشکلات فیزیکی در مسکو کمک کرد. یعنی به لطف رادرفورد بخش قابل توجهی از فیزیک شوروی اتفاق افتاد. مدل سیاره ای اتم 19. در مدل سیاره ای اتم فرض شده است که عدد 1) الکترون های موجود در مدار برابر با تعداد پروتون های هسته است 2) پروتون ها برابر با تعداد نوترون های هسته هستند 3) الکترون های موجود در مدار برابر است با مجموع تعداد پروتون ها و نوترون های هسته 4) نوترون های موجود در هسته برابر است با مجموع تعداد الکترون های موجود در مدار و پروتون های موجود در هسته 21. مدل سیاره ای اتم با آزمایشاتی که بر روی آن انجام شده است توجیه می شود 1) انحلال و ذوب جامدات 2) یونیزاسیون گاز 3) تولید شیمیایی مواد جدید 4) پراکندگی ذرات α 24. مدل سیاره ای اتم موجه است 1) محاسبات حرکت اجرام سماوی 2) آزمایشات بر روی برق رسانی 3) آزمایش بر روی پراکندگی ذرات α 4) عکس از اتم ها در میکروسکوپ 44. در آزمایش رادرفورد، ذرات آلفا پراکنده می شوند 1) میدان الکترواستاتیک هسته اتم 2) پوسته الکترونی اتم های هدف 3) میدان گرانشی هسته اتم 4) سطح هدف 48. در آزمایش رادرفورد، اکثر ذرات α آزادانه از فویل عبور می کنند، عملاً بدون انحراف از مسیرهای مستقیم، زیرا 1) هسته اتم دارای بار مثبت است 2) الکترون ها دارای بار منفی هستند 3) هسته یک اتم ابعاد کوچکی (در مقایسه با اتم) دارد 4) ذرات α دارای جرم بزرگ (در مقایسه با هسته اتمی) هستند 154. کدام عبارات با مدل سیاره ای اتم مطابقت دارد؟ 1) هسته در مرکز اتم قرار دارد، بار هسته مثبت است، الکترون ها در مدارهای اطراف هسته قرار دارند. 2) هسته در مرکز اتم است، بار هسته منفی است، الکترون ها در مدارهای دور هسته قرار دارند. 3) الکترون ها در مرکز اتم هستند، هسته به دور الکترون ها می چرخد، بار هسته مثبت است. 4) الکترون ها در مرکز اتم هستند، هسته به دور الکترون ها می چرخد، بار هسته منفی است. 225. آزمایشات رادرفورد در مورد پراکندگی ذرات α نشان داد که الف. تقریباً تمام جرم یک اتم در هسته متمرکز است. ب- هسته بار مثبت دارد. کدام عبارت صحیح است؟ 1) فقط A 2) فقط B 3) هر دو A و B 4) نه A و نه B 259. کدام ایده از ساختار اتم با مدل رادرفورد اتم مطابقت دارد؟ 1) هسته در مرکز اتم است، الکترون ها در مدارهای اطراف هسته قرار دارند، بار الکترون مثبت است. 2) هسته در مرکز اتم است، الکترون ها در مدارهای اطراف هسته قرار دارند، بار الکترون ها منفی است. 3) بار مثبت به طور مساوی در سراسر اتم توزیع شده است، الکترون های موجود در اتم ارتعاش می کنند. 4) بار مثبت به طور مساوی در سراسر اتم توزیع می شود و الکترون ها در اتم در مدارهای مختلف حرکت می کنند. 266. کدام نظر در مورد ساختار اتم صحیح است؟ بیشتر جرم یک اتم متمرکز است 1) در هسته، بار الکترون مثبت است 2) در هسته، بار هسته ای منفی است. 3) در الکترون ها، بار الکترون ها منفی است 4) در هسته، بار الکترون ها منفی است. 254. کدام ایده از ساختار اتم با مدل رادرفورد اتم مطابقت دارد؟ 1) هسته در مرکز اتم است، بار هسته مثبت است، بیشتر جرم اتم در الکترون متمرکز است. 2) هسته در مرکز اتم است، بار هسته منفی است، بیشتر جرم اتم در لایه الکترونی متمرکز است. 3) هسته - در مرکز اتم، بار هسته مثبت است، بیشتر جرم اتم در هسته متمرکز است. 4) هسته در مرکز اتم است، بار هسته منفی است، بیشتر جرم اتم در هسته متمرکز است. فرضیه های بور 267. نمودار پایین ترین سطوح انرژی اتم های یک گاز اتمی کمیاب به شکل نشان داده شده در شکل است. در لحظه اولیه زمان، اتم ها در حالتی با انرژی E هستند (2) طبق فرضیه های بور، این گاز می تواند فوتون هایی با انرژی ساطع کند. 1) 0.3 eV، 0.5 eV و 1.5 eV 2) 0.3 eV فقط 3) 1.5 eV فقط 4) هر کدام در محدوده 0 تا 0.5 eV 273. شکل نموداری از پایین ترین سطوح انرژی یک اتم را نشان می دهد. در لحظه اولیه زمان، اتم در حالتی با انرژی E (2) قرار دارد. طبق فرضیه های بور، یک اتم معین می تواند فوتون هایی با انرژی ساطع کند
1) 1 ∙ 10 -19 J 2) 3 ∙ 10 -19 J 3) 5 ∙ 10 -19 J 4) 6 ∙ 10 -19 J 279. فرکانس فوتون گسیل شده از اتم با توجه به مدل اتمی بور چگونه تعیین می شود؟ 1) تفاوت در انرژی حالت های ساکن 2) فرکانس چرخش الکترون در اطراف هسته 3) طول موج د بروگلی برای الکترون 4) مدل بور اجازه نمی دهد آن را تعیین کند. 15. اتم در حالتی با انرژی E 1 قرار دارد< 0. Минимальная энергия, необходимая для отрыва электрона от атома, равна 1) 0 2) E 1 3) - E 1 4) - E 1 / 2 16. اتم های هیدروژن در حالت برانگیخته دوم چند فوتون با فرکانس های مختلف می توانند ساطع کنند؟
1) 1 2) 2 3) 3 4) 4 25. فرض کنید انرژی اتم های گاز فقط می تواند مقادیر نشان داده شده در نمودار را بگیرد. اتم ها در حالتی با انرژی e هستند (3). این گاز چه فوتون هایی را می تواند جذب کند؟
1) هر در محدوده 2 ∙ 10 -18 J تا 8 ∙ 10 -18 J 2) هر، اما کمتر از 2 ∙ 10 -18 J 3) فقط 2 ∙ 10 -18 J 4) هر کدام، بزرگتر یا مساوی 2 ∙ 10 -18 J 29. هنگامی که یک فوتون با انرژی 6 eV گسیل می شود، بار اتم 1) تغییر نمی کند 2) 9.6 ∙ 10 -19 درجه سانتیگراد افزایش می یابد 3) 1.6 ∙ 10 -19 C 4) 9.6 ∙10 -19 C کاهش می یابد 30. نور با فرکانس 4 ∙ 10 15 هرتز از فوتون هایی با بار الکتریکیبرابر 1) 1.6 ∙ 10 -19 Cl 2) 6.4 ∙ 10 -19 Cl 3) 0 Cl 4) 6.4 ∙ 10 -4 Cl 78. یک الکترون در لایه بیرونی اتم ابتدا از حالت ساکن با انرژی E 1 به حالت ساکن با انرژی E 2 می رود و فوتونی را با فرکانس جذب می کند. v 1. سپس از حالت E 2 به حالت ساکن با انرژی E 3 می رود و فوتونی را با فرکانس جذب می کند. v 2 > v 1. وقتی یک الکترون از حالت E 2 به حالت E 1 تغییر می کند چه اتفاقی می افتد. 1) گسیل فرکانس نور v 2 – v 1 2) جذب نور توسط فرکانس v 2 – v 1 3) گسیل فرکانس نور v 2 + v 1 4) جذب نور توسط فرکانس v 2 – v 1 90. انرژی فوتون جذب شده توسط اتم در حین انتقال از حالت پایه با انرژی E 0 به حالت برانگیخته با انرژی E 1 برابر است با (h - ثابت پلانک)
95. شکل سطوح انرژی یک اتم را نشان می دهد و طول موج فوتون های گسیل شده و جذب شده در طول انتقال از یک سطح به سطح دیگر را نشان می دهد. طول موج فوتون های ساطع شده در طول انتقال از سطح E 4 به سطح E 1 چقدر است، اگر λ 13 = 400 نانومتر، λ 24 = 500 نانومتر، λ 32 = 600 نانومتر؟ پاسخ خود را بر حسب نانومتر بیان کنید و به اعداد کامل گرد کنید.
96. شکل چندین سطح انرژی پوسته الکترونی یک اتم را نشان می دهد و فرکانس فوتون های گسیل شده و جذب شده در طول انتقال بین این سطوح را نشان می دهد. حداقل طول موج فوتون هایی که از یک اتم ساطع می شود چقدر است؟ هر انتقال های احتمالیبین سطوح E 1، E 2، e s و E 4، اگر v 13 = 7 ∙ 10 14 هرتز، v 24 = 5 ∙ 10 14 هرتز، v 32 = 3 ∙ 10 14 هرتز؟ پاسخ خود را بر حسب نانومتر بیان کنید و به اعداد کامل گرد کنید.
120. شکل نمودار سطوح انرژی یک اتم را نشان می دهد. کدام یک از انتقال بین سطوح انرژی که با فلش مشخص شده اند با جذب کوانتومی با فرکانس حداقل همراه است؟
1) از سطح 1 تا سطح 5 2) از سطح 1 تا سطح 2 124. شکل سطوح انرژی یک اتم را نشان می دهد و طول موج فوتون های گسیل شده و جذب شده در طول انتقال از یک سطح به سطح دیگر را نشان می دهد. به طور تجربی ثابت شده است که حداقل طول موج برای فوتون های ساطع شده در طول انتقال بین این سطوح λ 0 = 250 نانومتر است. اگر λ 32 = 545 نانومتر، λ 24 = 400 نانومتر، مقدار λ 13 چقدر است؟
145. شکل نموداری از مقادیر ممکن انرژی اتم های یک گاز کمیاب را نشان می دهد. در لحظه اولیه زمان، اتم ها در حالتی با انرژی E هستند (3). این امکان وجود دارد که یک گاز فوتون های با انرژی ساطع کند
1) فقط 2 ∙ 10 -18 J 2) فقط 3 ∙ 10 -18 و 6 ∙ 10 -18 J 3) فقط 2 ∙ 10 -18، 5 ∙ 10 -18 و 8 ∙ 10 -18 J 4) هر کدام از 2 ∙ 10 -18 تا 8 ∙ 10 -18 J 162. سطوح انرژی الکترون در اتم هیدروژن با فرمول E n = - 13.6/n 2 eV، که در آن n = 1، 2، 3، ... به دست می آید. هنگامی که یک اتم از حالت E 2 به حالت E 1 می رود، اتم یک فوتون ساطع می کند. هنگامی که فوتون بر روی سطح فوتوکاتد قرار می گیرد، یک فوتوالکترون را از بین می برد. طول موج نور مربوط به مرز قرمز اثر فوتوالکتریک برای مواد سطح فوتوکاتد λcr = 300 نانومتر است. حداکثر سرعت ممکن فوتوالکترون چقدر است؟ 180. شکل چند مورد از پایین ترین سطوح انرژی اتم هیدروژن را نشان می دهد. آیا یک اتم در حالت E 1 می تواند فوتونی با انرژی 3.4 eV را جذب کند؟
1) بله، در این حالت اتم به حالت E 2 می رود 2) بله، در این حالت اتم به حالت E 3 می رود 3) بله، در این حالت اتم یونیزه می شود و به یک پروتون و یک الکترون تجزیه می شود. 4) خیر، انرژی فوتون برای انتقال اتم به حالت برانگیخته کافی نیست 218. شکل یک نمودار ساده از سطوح انرژی یک اتم را نشان می دهد. فلش های شماره دار برخی از انتقال اتمی احتمالی بین این سطوح را نشان می دهد. بین فرآیندهای جذب نور با طولانیترین طول موج و گسیل نور با طولانیترین طول موج و فلشهایی که انتقال انرژی اتم را نشان میدهند، مطابقت ایجاد کنید. برای هر موقعیت در ستون اول، موقعیت مربوطه را در ستون دوم انتخاب کنید و اعداد انتخاب شده را در جدول زیر حروف مربوطه یادداشت کنید.
226. شکل قطعه ای از نمودار سطح انرژی اتمی را نشان می دهد. کدام یک از انتقال بین سطوح انرژی که با فلش مشخص شده اند با گسیل فوتون با حداکثر انرژی همراه است؟
1) از سطح 1 تا سطح 5 2) از سطح 5 به سطح 2 3) از سطح 5 تا سطح 1 4) از سطح 2 به سطح 1 228. شکل چهار سطح انرژی پایین اتم هیدروژن را نشان می دهد. چه انتقالی مربوط به جذب فوتون با انرژی 12.1 eV توسط یک اتم است؟
1) E 3 → E 1 2) E 1 → E 3 3) E 3 → E 2 4) E 1 → E 4 238. الکترون با تکانه p = 2 ∙ 10 -24 kg ∙ m / s با یک پروتون در حال سکون برخورد می کند و یک اتم هیدروژن در حالت با انرژی E n (n = 2) تشکیل می دهد. در طول تشکیل یک اتم، یک فوتون ساطع می شود. فرکانس را پیدا کنید vاین فوتون، انرژی جنبشی اتم را نادیده می گیرد. سطوح انرژی الکترون در اتم هیدروژن با فرمولی که n = 1،2، 3، ... داده می شود. 260- نمودار پایین ترین سطوح انرژی یک اتم به شکلی است که در شکل نشان داده شده است. در لحظه اولیه زمان، اتم در حالتی با انرژی E (2) قرار دارد. طبق فرضیه های بور، یک اتم می تواند فوتون هایی با انرژی ساطع کند 1) فقط 0.5 eV 2) فقط 1.5 eV 3) کمتر از 0.5 eV 4) هر یک در محدوده 0.5 تا 2 eV 269. شکل نمودار سطوح انرژی یک اتم را نشان می دهد. چه عددی انتقال متناظر را نشان می دهد تشعشعفوتون با کمترین انرژی؟
1) 1 2) 2 3) 3 4) 4 282. گسیل فوتون توسط اتم زمانی اتفاق می افتد که 1) حرکت الکترون در مدار ثابت 2) انتقال یک الکترون از حالت پایه به حالت برانگیخته 3) انتقال یک الکترون از حالت برانگیخته به حالت پایه 4) تمام فرآیندهای ذکر شده 13. گسیل فوتون در طول انتقال از حالت های برانگیخته با انرژی های E 1 > E 2 > E 3 به حالت پایه رخ می دهد. برای فرکانس های فوتون های مربوطه v 1، v 2، v 3، رابطه معتبر است 1) v 1 < v 2 < v 3 2) v 2 < v 1 < v 3 3) v 2 < v 3 < v 1 4) v 1 > v 2 > v 3 1) بزرگتر از صفر 2) مساوی صفر 3) کوچکتر از صفر 4) بیشتر یا کمتر از صفر بسته به حالت 98. یک اتم در حال سکون، فوتونی با انرژی 1.2 ∙ 10 -17 ژول را جذب کرد. در این مورد، تکانه اتم 1) تغییر نکرد 2) برابر 1.2 ∙ 10 -17 کیلوگرم ∙ m/s شد 3) برابر 4 ∙ 10 -26 کیلوگرم ∙ m/s شد 4) برابر با 3.6 ∙ 10 -9 کیلوگرم ∙ m/s شد 110. فرض کنید نمودار سطوح انرژی اتم های یک ماده خاص به شکل در شکل نشان داده شده است و اتم ها در حالتی با انرژی E هستند (1). الکترونی که با انرژی جنبشی 1.5 ولت ولت حرکت می کرد با یکی از این اتم ها برخورد کرد و به بیرون برگشت و مقداری انرژی اضافی به دست آورد. با فرض اینکه اتم قبل از برخورد در حالت سکون بوده است، تکانه الکترون را پس از برخورد تعیین کنید. امکان تابش نور اتم هنگام برخورد با الکترون را نادیده بگیرید. 111. فرض کنید نمودار سطوح انرژی اتم های یک ماده خاص به شکلی باشد که در شکل نشان داده شده است و اتم ها در حالتی با انرژی E هستند (1). الکترونی که با یکی از این اتم ها برخورد می کرد، منعکس شد و مقداری انرژی اضافی به دست آورد. تکانه الکترون پس از برخورد با یک اتم ساکن برابر با 1.2 ∙ 10 -24 کیلوگرم ∙ m/s بود. انرژی جنبشی الکترون را قبل از برخورد تعیین کنید. امکان تابش نور اتم هنگام برخورد با الکترون را نادیده بگیرید. 136. مزون π° با جرم 2.4 ∙ 10 -28 کیلوگرم به دو کوانتا γ تجزیه می شود. بزرگی تکانه یکی از کوانتوم های γ حاصل را در قاب مرجع که مزون π ° اولیه در آن ساکن است، بیابید. 144. ظرف حاوی هیدروژن اتمی کمیاب است. یک اتم هیدروژن در حالت پایه (E 1 = - 13.6 eV) فوتون را جذب کرده و یونیزه می شود. الکترونی که در نتیجه یونیزاسیون از اتم ساطع می شود با سرعت v = 1000 کیلومتر بر ثانیه از هسته دور می شود. فرکانس فوتون جذب شده چقدر است؟ انرژی حرکت حرارتی اتم های هیدروژن را نادیده بگیرید. 197. یک اتم هیدروژن در حالت سکون در حالت پایه (E 1 = - 13.6 eV) فوتونی را در خلاء با طول موج λ = 80 نانومتر جذب می کند. الکترونی که در نتیجه یونیزاسیون از اتم ساطع می شود با چه سرعتی از هسته دور می شود؟ انرژی جنبشی یون تشکیل شده را نادیده بگیرید. 214. یک پیون آزاد (مزون π°) با انرژی استراحت 135 مگا ولت با سرعت v حرکت می کند که به طور قابل توجهی کمتر از سرعت نور است. در نتیجه فروپاشی آن، دو کوانتا γ تشکیل شد که یکی از آنها در جهت حرکت پیون و دیگری در جهت مخالف انتشار می یابد. انرژی یک کوانتوم 10 درصد بیشتر از دیگری است. سرعت پایون قبل از پوسیدگی چقدر است؟ 232. جدول مقادیر انرژی برای سطوح انرژی دوم و چهارم اتم هیدروژن را نشان می دهد.
انرژی فوتون ساطع شده توسط اتم در هنگام گذار از سطح چهارم به سطح دوم چقدر است؟ 1) 5.45 ∙ 10 -19 J 2) 1.36 ∙ 10 -19 J 3) 6.81 ∙ 10 -19 J 4) 4.09 ∙ 10 -19 J 248. یک اتم در حالت سکون، در نتیجه انتقال یک الکترون از حالت برانگیخته به حالت پایه، فوتونی با انرژی 16.32 ∙ 10 -19 J منتشر می کند. در نتیجه پس زدن، اتم شروع به حرکت انتقالی در جهت مخالف با انرژی جنبشی 8.81 ∙ 10 -27 J. جرم اتم را پیدا کنید. سرعت یک اتم در مقایسه با سرعت نور کوچک در نظر گرفته می شود. 252. ظرف حاوی هیدروژن اتمی کمیاب است. یک اتم هیدروژن در حالت پایه (E1 = -13.6 eV) فوتون را جذب کرده و یونیزه می شود. الکترونی که در نتیجه یونیزاسیون از اتم ساطع می شود با سرعت 1000 کیلومتر بر ثانیه از هسته دور می شود. طول موج فوتون جذب شده چقدر است؟ انرژی حرکت حرارتی اتم های هیدروژن را نادیده بگیرید. 1) 46 نانومتر 2) 64 نانومتر 3) 75 نانومتر 4) 91 نانومتر 257. ظرف حاوی هیدروژن اتمی کمیاب است. یک اتم هیدروژن در حالت پایه (E1 = -13.6 eV) فوتون را جذب کرده و یونیزه می شود. الکترونی که در نتیجه یونیزاسیون از اتم ساطع می شود با سرعت v = 1000 کیلومتر بر ثانیه از هسته دور می شود. انرژی فوتون جذب شده چقدر است؟ انرژی حرکت حرارتی اتم های هیدروژن را نادیده بگیرید. 1) 13.6 eV 2) 16.4 eV 3) 19.3 eV 4) 27.2 eV 1 | | | | مسکو دانشگاه دولتیآمار اقتصاد علوم کامپیوتر چکیده در مورد رشته: "KSE" در مورد موضوع : "مدل سیاره ای اتم" تکمیل شد: دانشجوی سال 3 گروه های DNF-301 روزیف تمور معلم: موسولوف D.N. مسکو 2008 اولین نظریه اتمی دالتون فرض میکرد که جهان متشکل از تعداد معینی اتم - بلوکهای ساختمانی اولیه - با ویژگیهای مشخصهای است که ابدی و تغییرناپذیر هستند. دامنه عظیم کار علمیرادرفورد در مونترال - او 66 مقاله را هم شخصا و هم به طور مشترک با دانشمندان دیگر منتشر کرد، بدون احتساب کتاب "رادیواکتیویته" - شهرت یک محقق درجه یک را برای رادرفورد به ارمغان آورد. او برای گرفتن یک صندلی در منچستر دعوت نامه دریافت می کند. در 24 می 1907، رادرفورد به اروپا بازگشت. شروع شد دوره جدیدزندگی او اولین تلاش برای ایجاد مدلی از اتم بر اساس داده های تجربی انباشته شده متعلق به J. Thomson (1903) است. او معتقد بود که اتم یک سیستم کروی خنثی با شعاع تقریباً 10-10 متر است، بار مثبت اتم به طور مساوی در کل حجم توپ توزیع می شود و الکترون های دارای بار منفی در داخل آن قرار دارند. برای توضیح طیف گسیل خطی اتم ها، تامسون سعی کرد مکان الکترون ها را در یک اتم تعیین کند و فرکانس ارتعاشات آنها را در اطراف موقعیت های تعادل محاسبه کند. با این حال، این تلاش ها ناموفق بود. چند سال بعد، در آزمایشات فیزیکدان بزرگ انگلیسی E. Rutherford، نادرست بودن مدل تامسون ثابت شد. فیزیکدان انگلیسی E. Rutherford ماهیت این تابش را بررسی کرد. معلوم شد که پرتوی از تشعشعات رادیواکتیو در یک میدان مغناطیسی قوی به سه قسمت تقسیم شده است: تابش a-، b- و y. پرتوهای b نشان دهنده جریانی از الکترون ها، پرتوهای a نشان دهنده هسته اتم هلیوم و پرتوهای y نشان دهنده تابش الکترومغناطیسی موج کوتاه هستند. پدیده رادیواکتیویته طبیعی ساختار پیچیده اتم را نشان می دهد. در سال 1913، نیلز بور نتایج بازتابها و محاسبات طولانی را منتشر کرد، که مهمترین آنها از آن زمان به عنوان فرضیات بور شناخته شدند: در یک اتم همیشه تعداد زیادی مدار ثابت و کاملاً مشخص وجود دارد که یک الکترون میتواند به طور نامحدود در امتداد آنها حرکت کند. زیرا تمام نیروهای وارد بر آن متعادل می شوند. یک الکترون می تواند در یک اتم فقط از یک مدار پایدار به مداری دیگر به همان اندازه پایدار حرکت کند. اگر در طول چنین انتقالی، الکترون از هسته دور شود، لازم است که از خارج مقدار معینی انرژی برابر با اختلاف ذخیره انرژی الکترون در مدار بالا و پایین به آن منتقل شود. اگر یک الکترون به هسته نزدیک شود، انرژی اضافی را به شکل تابش "دفع" می کند. فرض اول:
فرض دوم:
اصل سوم:
1. از حالت ساکن زمین به حالت برانگیخته،
2. از حالت ساکن برانگیخته به حالت پایه. فرضیه های بور با قوانین فیزیک کلاسیک در تضاد است. بیان می کنند ویژگی مشخصهریزجهان - ماهیت کوانتومی پدیده هایی که در آنجا رخ می دهند. نتیجه گیری بر اساس فرضیه های بور با آزمایش تطابق خوبی دارد. به عنوان مثال، آنها الگوهای طیف اتم هیدروژن، منشاء طیف مشخصه پرتوهای ایکس و غیره را توضیح می دهند. در شکل شکل 3 بخشی از نمودار انرژی حالت های ساکن اتم هیدروژن را نشان می دهد. فلش ها انتقال اتمی منجر به انتشار انرژی را نشان می دهد. مشاهده می شود که خطوط طیفی به صورت سری ترکیب می شوند و در سطحی که اتم از سطوح دیگر (بالاتر) به آن منتقل می شود، متفاوت است. با دانستن تفاوت بین انرژیهای الکترون در این مدارها، میتوان منحنی ایجاد کرد که طیف گسیل هیدروژن را در حالتهای مختلف برانگیخته توصیف میکند و تعیین میکند که اگر انرژی اضافی از خارج به آن داده شود، اتم هیدروژن چه طول موجهایی را بهویژه باید به راحتی ساطع کند. به عنوان مثال، استفاده از لامپ های نور جیوه ای روشن. این منحنی نظری کاملاً با طیف انتشار اتم های هیدروژن برانگیخته که توسط دانشمند سوئیسی J. Balmer در سال 1885 اندازه گیری شد، منطبق بود! ادبیات استفاده شده:
پایداری هر سیستمی در مقیاس اتمی از اصل عدم قطعیت هایزنبرگ (بخش چهارم از فصل هفتم) ناشی می شود. بنابراین، مطالعه مداوم خواص اتم تنها در چارچوب نظریه کوانتومی امکان پذیر است. با این حال، برخی از نتایج مهم است اهمیت عملیرا می توان با اتخاذ قوانین کوانتیزاسیون مداری اضافی در چارچوب مکانیک کلاسیک به دست آورد. در این فصل، ما موقعیت سطوح انرژی اتم هیدروژن و یون های هیدروژن مانند را محاسبه خواهیم کرد. محاسبات بر اساس مدل سیاره ای است که بر اساس آن الکترون ها تحت تأثیر نیروهای جاذبه کولن به دور هسته می چرخند. ما فرض می کنیم که الکترون ها در مدارهای دایره ای حرکت می کنند. 13.1. اصل مکاتبهکوانتیزاسیون تکانه زاویه ای در مدل اتم هیدروژن که توسط بور در سال 1913 ارائه شد، استفاده می شود. بور از این واقعیت نتیجه گرفت که در حد کوانتوم انرژی کوچک، نتایج نظریه کوانتومی باید با نتایج مکانیک کلاسیک مطابقت داشته باشد. او سه فرض را تدوین کرد. یک اتم فقط در حالت های خاصی با سطوح انرژی گسسته می تواند برای مدت طولانی باقی بماند E من . الکترونها که در مدارهای مجزای متناظر می چرخند، با شتاب حرکت می کنند، اما با این وجود، تابش نمی کنند. (در الکترودینامیک کلاسیک، هر ذره متحرک شتابدار اگر بار غیر صفر داشته باشد، تابش می کند). تشعشعات در طول انتقال بین سطوح انرژی توسط کوانتوم ها ساطع یا جذب می شوند:  از این فرضیه ها قانون کمی کردن تکانه زاویه ای یک الکترون را دنبال می کند
کجا nمی تواند برابر با هر عدد طبیعی باشد: پارامتر nتماس گرفت عدد کوانتومی اصلی. برای استخراج فرمول (1.1)، انرژی تراز را بر حسب گشتاور بیان می کنیم. اندازهگیریهای نجومی به دانش طول موجها با دقت نسبتاً بالا نیاز دارند: شش عدد صحیح برای خطوط نوری و تا هشت عدد در محدوده رادیویی. بنابراین، هنگام مطالعه اتم هیدروژن، فرض یک جرم بی نهایت بزرگ از هسته بسیار خشن است، زیرا منجر به خطا در چهارم می شود. رقم قابل توجهی. باید حرکت هسته را در نظر گرفت. برای در نظر گرفتن آن، این مفهوم معرفی شده است کاهش جرم 13.2. کاهش جرمیک الکترون تحت تأثیر نیروی الکترواستاتیک در اطراف هسته حرکت می کند
کجا r- برداري كه ابتداي آن با موقعيت هسته منطبق است و انتهاي آن به الكترون اشاره مي كند. این را به شما یادآوری کنیم زعدد اتمی هسته است و بارهای هسته و الکترون به ترتیب برابر هستند Zeو
بیایید متغیرهای جدیدی را معرفی کنیم: سرعت الکترون نسبت به هسته
و سرعت مرکز جرم
با افزودن (2.2a) و (2.2b)، به دست می آوریم
بنابراین، مرکز جرم سیستم بسته به طور یکنواخت و مستقیم حرکت می کند. حالا بیایید (2.2b) را بر تقسیم کنیم متر زو آن را از (2.2a) کم کنید، تقسیم بر متر ه. نتیجه معادله ای برای سرعت نسبی الکترون است:
مقدار موجود در آن
تماس گرفت کاهش جرم. بنابراین، مشکل حرکت مشترک دو ذره - یک الکترون و یک هسته - ساده شده است. کافی است حرکت اطراف هسته یک ذره را در نظر بگیریم که موقعیت آن با موقعیت الکترون منطبق است و جرم آن برابر با جرم کاهش یافته سیستم است. 13.3. رابطه بین انرژی و گشتاورنیروی اندرکنش کولن در امتداد خط مستقیمی که بارها را به هم وصل می کند هدایت می شود و مدول آن فقط به فاصله بستگی دارد. rبین آنها در نتیجه، معادله (2.5) حرکت یک ذره را در یک میدان متقارن مرکزی توصیف می کند. یکی از ویژگی های مهم حرکت در یک میدان با تقارن مرکزی، حفظ انرژی و گشتاور است. اجازه دهید این شرط را بنویسیم که حرکت الکترون در مدار دایره ای با جاذبه کولن به هسته تعیین می شود:
از این نتیجه می شود که انرژی جنبشی
برابر با نصف انرژی پتانسیل
با علامت مخالف گرفته شده است:
انرژی کل E،به ترتیب، برابر است با:
معلوم شد که منفی است، همانطور که برای ایالت های باثبات باید باشد. حالات اتم ها و یون های دارای انرژی منفی نامیده می شوند مرتبط. ضرب معادله (3.4) در 2 rو محصول را در سمت چپ جایگزین کنید مترVrدر لحظه چرخش م, بیایید سرعت را بیان کنیم V در یک لحظه:
با جایگزینی مقدار سرعت حاصل به (3.5)، فرمول مورد نیاز برای انرژی کل را به دست می آوریم:
بیایید به این نکته توجه کنیم که انرژی با قدرت زوج گشتاور متناسب است. در نظریه بور، این واقعیت پیامدهای مهمی دارد. 13.4. کوانتیزاسیون گشتاورمعادله دوم برای متغیرها Vو rما از قاعده کوانتیزاسیون مداری به دست می آوریم که اشتقاق آن بر اساس فرضیه های بور انجام می شود. با تمایز فرمول (3.5)، ارتباط بین تغییرات کوچک گشتاور و انرژی را بدست می آوریم:
طبق فرض سوم، فرکانس فوتون گسیل شده (یا جذب شده) برابر با فرکانس چرخش الکترون در مدار است:
از فرمول های (3.4)، (4.2) و اتصال
بین سرعت، گشتاور و شعاع، یک عبارت ساده برای تغییر تکانه زاویه ای در طول انتقال یک الکترون بین مدارهای مجاور وجود دارد:
با یکپارچه سازی (4.3)، به دست می آوریم ثابت سیما در یک فاصله نیمه باز جستجو خواهیم کرد
نابرابری مضاعف (4.5) هیچ محدودیت اضافی ایجاد نمی کند: اگر بااز مرزهای (4.5) فراتر می رود، سپس با شماره گذاری مجدد مقادیر لحظه در فرمول (4.4) می توان آن را به این بازه برگرداند. قوانین فیزیکی در همه سیستم های مرجع یکسان است. بیایید از یک سیستم مختصات راست دست به سمت چپ حرکت کنیم. انرژی، مانند هر کمیت اسکالر، ثابت خواهد ماند،
بردار گشتاور محوری رفتار متفاوتی دارد. همانطور که مشخص است، هر بردار محوری هنگام انجام عملیات مشخص شده، علامت را تغییر می دهد: هیچ تناقضی بین (4.6) و (4.7) وجود ندارد، زیرا انرژی مطابق با (3.7) با مربع لحظه نسبت معکوس دارد و هنگامی که علامت تغییر می کند ثابت می ماند. م. بنابراین، مجموعه مقادیر گشتاور منفی باید مجموعه مقادیر مثبت خود را تکرار کند. به عبارت دیگر، برای هر ارزش مثبت م nباید یک مقدار منفی برابر با مقدار مطلق آن وجود داشته باشد م – متر : با ترکیب (4.4) - (4.8)، یک معادله خطی برای به دست می آوریم با:
با یک راه حل
به راحتی می توان تأیید کرد که فرمول (4.9) دو مقدار از ثابت را می دهد با، نابرابری ارضا کننده (4.5):
نتیجه به دست آمده توسط جدولی نشان داده شده است که سری گشتاور را برای سه مقدار C نشان می دهد: 0، 1/2 و 1/4. به وضوح مشاهده می شود که در خط آخر ( n= 1/4) مقدار گشتاور برای مقادیر مثبت و منفی nدر قدر مطلق متفاوت است. بور با تنظیم ثابت توانست با داده های تجربی موافقت کند سیبرابر با صفر سپس قانون کوانتیزه کردن تکانه مداری با فرمول (1) توضیح داده می شود. اما معنا و مفهوم هم دارد سیبرابر با نصف توصیف می کند لحظه داخلیالکترون یا آن چرخش- مفهومی که در فصول دیگر به تفصیل مورد بحث قرار خواهد گرفت. مدل سیاره ای اتم اغلب با فرمول (1) ارائه می شود، اما از نظر تاریخی از اصل مطابقت مشتق شده است. 13.5. پارامترهای مداری الکترونفرمول های (1.1) و (3.7) به مجموعه ای مجزا از شعاع مداری و سرعت الکترون منتهی می شوند که می توانند با استفاده از عدد کوانتومی دوباره شماره گذاری شوند. n: آنها با یک طیف انرژی گسسته مطابقت دارند. انرژی کل الکترون E nمی توان با استفاده از فرمول های (3.5) و (5.1) محاسبه کرد:
ما مجموعه ای مجزا از حالات انرژی یک اتم هیدروژن یا یون هیدروژن مانند را به دست آورده ایم. حالت مربوط به مقدار nبرابر با یک نامیده می شود اصلی،هر کس دیگری - هیجان زده،چه می شود اگر n
خیلی بزرگ، پس - بسیار هیجان زدهشکل 13.5.1 فرمول (5.2) اتم هیدروژن را نشان می دهد. خط نقطه چین وضعیت. با نزدیک شدن به مرز یونیزاسیون، سطوح در شکل 13.5.2 به تدریج متراکم تر می شوند. در فصل اول ما Rydberg را بر اساس ملاحظات ابعادی معرفی کردیم. فرمول (5.2) معنای فیزیکی این ثابت را به عنوان یک واحد اندازه گیری مناسب انرژی اتمی نشان می دهد. علاوه بر این، نشان می دهد که Ry به رابطه بستگی دارد
به دلیل اختلاف زیاد جرم هسته و الکترون، این وابستگی بسیار ضعیف است، اما در برخی موارد نمی توان از آن چشم پوشی کرد. شمارنده آخرین فرمول دارای یک ثابت است
که مقدار Ry با افزایش نامحدود در جرم هسته به آن گرایش دارد. بنابراین، واحد اندازه گیری Ry را که در فصل اول ارائه شده است، روشن کرده ایم. البته قانون کوانتیزاسیون لحظه ای (1.1) نسبت به بیان (12.6.1) برای مقدار ویژه عملگر دقت کمتری دارد. بنابراین، طبق مدل سیارهای اتم، در حالتهای محدود، سرعت چرخش، شعاع مداری و انرژی الکترون یک سری مقادیر گسسته به خود میگیرند و کاملاً با مقدار عدد کوانتومی اصلی تعیین میشوند. ایالات با انرژی مثبتتماس گرفت رایگان; آنها کوانتیزه نیستند و تمام پارامترهای الکترون موجود در آنها، به جز لحظه چرخش، می توانند مقادیری را بگیرند که با قوانین بقای مغایرت نداشته باشد. گشتاور همیشه کوانتیزه می شود. فرمول های مدل سیاره ای امکان محاسبه پتانسیل یونیزاسیون اتم هیدروژن یا یون هیدروژن مانند و همچنین طول موج انتقال بین حالت های با معانی مختلف nشما همچنین می توانید اندازه اتم، سرعت خطی و زاویه ای الکترون را در مدار آن تخمین بزنید. فرمول های مشتق شده دو محدودیت دارند. اولاً، آنها اثرات نسبیتی را در نظر نمی گیرند، که یک خطای سفارش می دهد ( V/ج) 2 . با افزایش بار هسته ای، تصحیح نسبیتی افزایش می یابد ز 4 و برای یون FeXXVI در حال حاضر کسری از درصد است. در پایان این فصل ما این اثر را در چارچوب مدل سیاره ای در نظر خواهیم گرفت. ثانیاً علاوه بر عدد کوانتومی nانرژی سطوح توسط پارامترهای دیگر - گشتاورهای مداری و داخلی الکترون تعیین می شود. بنابراین، سطوح به چندین زیرسطح تقسیم می شوند. مقدار تقسیم نیز متناسب است ز 4 و برای یون های سنگین قابل توجه می شود. تمام ویژگی های سطوح گسسته در نظریه کوانتومی سازگار در نظر گرفته می شود. با این وجود، نظریه ساده بور روشی ساده، راحت و نسبتاً دقیق برای مطالعه ساختار یونها و اتمها است. 13.6. ثابت رایدبرگدر محدوده نوری طیف، معمولاً انرژی کوانتومی اندازه گیری نمی شود E، و طول موج انتقال بین سطوح است. بنابراین، عدد موج اغلب برای اندازه گیری انرژی سطح استفاده می شود E/hc، بر حسب سانتی متر معکوس اندازه گیری می شود. عدد موج مربوطه
شاخص به ما یادآوری می کند که جرم هسته در این تعریف بی نهایت بزرگ در نظر گرفته می شود. با در نظر گرفتن جرم محدود هسته، ثابت ریدبرگ برابر است با
برای هسته های سنگین بیشتر از هسته های سبک است. نسبت جرم پروتون و الکترون است با جایگزینی این مقدار به (2.2) یک عبارت عددی برای ثابت Rydberg برای اتم هیدروژن بدست می آوریم: هسته یک ایزوتوپ سنگین هیدروژن - دوتریوم - از یک پروتون و یک نوترون تشکیل شده است و تقریباً دو برابر وزن هسته یک اتم هیدروژن - یک پروتون است. بنابراین با توجه به (6.2) ثابت ریدبرگ برای دوتریوم آر D بزرگتر از هیدروژن است آر H: حتی برای ایزوتوپ ناپایدار هیدروژن - تریتیوم که هسته آن از یک پروتون و دو نوترون تشکیل شده است، بالاتر است. برای عناصر وسط جدول تناوبی، اثر تغییر ایزوتوپی با اثر مرتبط با اندازه محدود هسته رقابت می کند. این اثرات علامت مخالف دارند و برای عناصر نزدیک به کلسیم یکدیگر را خنثی می کنند. 13.7. توالی ایزوالکترونیک هیدروژنبا توجه به تعریفی که در بخش چهارم از فصل هفتم ارائه شد، یون های متشکل از یک هسته و یک الکترون را شبه هیدروژن می نامند. به عبارت دیگر، آنها به دنباله ایزوالکترونیک هیدروژن اشاره می کنند. ساختار آنها از نظر کیفی یادآور اتم هیدروژن است و موقعیت سطوح انرژی یون هایی که بار هسته ای آنها خیلی زیاد نیست ( ز Z > 20)، تفاوتهای کمی مرتبط با اثرات نسبیتی به نظر میرسد: وابستگی جرم الکترون به سرعت و اندرکنش اسپین-مدار. ما به جالب ترین یون ها در اخترفیزیک نگاه خواهیم کرد: هلیوم، اکسیژن و آهن. در طیف سنجی، بار یک یون با استفاده از آن مشخص می شود نماد طیف سنجی, که در سمت راست نماد با اعداد رومی نوشته شده است عنصر شیمیایی. عددی که با عدد رومی نشان داده می شود، یک عدد بیشتر از تعداد الکترون های خارج شده از اتم است. به عنوان مثال، اتم هیدروژن با HI نشان داده می شود و یون های هیدروژن مانند هلیوم، اکسیژن و آهن به ترتیب HeII، OVIII و FeXXVI هستند. برای یونهای چندالکترونی، نماد طیفسنجی با بار مؤثری که الکترون ظرفیت «احساس میکند» منطبق است. اجازه دهید حرکت یک الکترون را در مدار دایره ای با در نظر گرفتن وابستگی نسبیتی جرم آن به سرعت محاسبه کنیم. معادلات (3.1) و (1.1) در حالت نسبیتی به این صورت است:
کاهش جرم متر با فرمول (2.6) تعریف می شود. این را نیز یادآوری کنیم
معادله اول را در ضرب کنید
ثابت ساختار ریز در فرمول (2.2.1) فصل اول معرفی شد. با دانستن سرعت، شعاع مدار را محاسبه می کنیم:
در نظریه نسبیت خاص، انرژی جنبشی برابر است با تفاوت بین انرژی کل یک جسم و انرژی استراحت آن در غیاب میدان نیروی خارجی:
انرژی بالقوه Uبه عنوان یک تابع rبا فرمول (3.3) تعیین می شود. جایگزین کردن به عبارات برای تی و Uمقادیر بدست آمده و r، انرژی کل الکترون را بدست می آوریم: برای الکترونی که در اولین مدار یک یون آهن شبیه هیدروژن می چرخد، مقدار 2 0.04 است. برای عناصر سبک تر، بر این اساس، حتی کمتر است. در
عبارت اول، همانطور که به راحتی قابل مشاهده است، با مقدار انرژی (5.2) در نظریه غیر نسبیتی بور، تا نماد برابر است، و دومی تصحیح نسبیتی مورد نظر را نشان می دهد. اجازه دهید عبارت اول را به عنوان نشان دهیم Eب، سپس
اجازه دهید یک عبارت صریح برای تصحیح نسبیتی بنویسیم:
بنابراین، مقدار نسبی تصحیح نسبیتی با حاصلضرب 2 متناسب است ز 4. در نظر گرفتن وابستگی جرم الکترون به سرعت منجر به افزایش عمق سطوح می شود. این را می توان به صورت زیر فهمید: قدر مطلق انرژی با جرم ذره افزایش می یابد و یک الکترون متحرک سنگین تر از یک الکترون ساکن است. تضعیف اثر با افزایش عدد کوانتومی nنتیجه حرکت کندتر الکترون در حالت برانگیخته است. وابستگی شدید به ز نتیجه سرعت بالای الکترون در میدان یک هسته با بار زیاد است. در آینده، ما این کمیت را طبق قوانین مکانیک کوانتومی محاسبه خواهیم کرد و نتیجه جدیدی به دست خواهیم آورد - حذف انحطاط در تکانه مداری. 13.8. حالت های بسیار هیجان زدهحالت یک اتم یا یون هر عنصر شیمیایی که یکی از الکترون ها در آن بالا باشد سطح انرژی، تماس گرفت بسیار هیجان زده، یا ریدبرگیان.آنها یک ویژگی مهم دارند: موقعیت سطوح یک الکترون برانگیخته را می توان با دقت کافی در چارچوب مدل بور توصیف کرد. واقعیت این است که یک الکترون با عدد کوانتومی بزرگ nطبق (5.1) از هسته و سایر الکترون ها بسیار دور است. در طیفسنجی، چنین الکترونی معمولاً «اپتیکال» یا «ظرفیت» نامیده میشود و الکترونهای باقیمانده همراه با هسته «بقایای اتمی» نامیده میشوند. ساختار شماتیک یک اتم با یک الکترون بسیار برانگیخته در شکل 13.8.1 نشان داده شده است. در پایین سمت چپ یک اتمی است
باقیمانده: هسته و الکترون ها در حالت پایه. فلش نقطه چین نشان دهنده الکترون ظرفیت است. فاصله بین تمام الکترون های موجود در یک باقیمانده اتمی بسیار کمتر از فاصله هر یک از آنها تا الکترون نوری است. بنابراین، بار کل آنها را می توان تقریباً به طور کامل در مرکز متمرکز دانست. بنابراین، میتوان فرض کرد که الکترون نوری تحت تأثیر نیروی کولن که به سمت هسته هدایت میشود، حرکت میکند و بنابراین سطوح انرژی آن با استفاده از فرمول بور (5.2) محاسبه میشود. الکترون های باقیمانده اتمی از هسته محافظت می کنند، اما نه به طور کامل. برای در نظر گرفتن غربالگری جزئی، این مفهوم معرفی شد شارژ موثرباقی مانده اتمی ز eff در مورد در نظر گرفته شده از یک الکترون بسیار دور، مقدار ز eff برابر با اختلاف عدد اتمی یک عنصر شیمیایی است ز و تعداد الکترون های باقیمانده اتمی. در اینجا ما خود را به مورد اتم های خنثی محدود می کنیم که برای آن ز eff = 1. موقعیت سطوح بسیار برانگیخته در نظریه بور برای هر اتمی به دست می آید. جایگزین کردن در (2.6) کافی است
می توانیم ثابت رایدبرگ را تابعی از وزن اتمی بیان کنیم الفعنصر شیمیایی مورد نظر:
سیاره ای مدل هااتم... + --- a -- = 0; (2.12) h² h ∂t 4πm ∂а а Δβ + 2 (grad agradβ) - ----- = 0. (2. 13 ) h ∂t برای βh φ = -- (2.14) 2πm مادلونگ معادله ... فصل 1 نوکلئون ها و هسته های اتمیسندنشان داده خواهد شد فصل 8، مغناطیسی ... رادرفورد در سال 1911 سیاره ایمدل هااتمدانشمند هلندی A. Van... واقعا افزایش یافته است سطحانرژی. هسته با نوترون ... سلولز موجود 13 اتم هااکسیژن، 34 اتمهیدروژن و 3 اتمکربن،... برنامه آموزشی موسسه آموزشی بودجه دولتی سالن تربیت بدنی شماره 625 برای سال تحصیلی 92/1391برنامه آموزشی اصلیارتقاء سطحصلاحیت ها، شایستگی ها و سطحپرداخت ... آزمون دولتی: 46 46 13 20 13 - 39 7 ... شعر واسیلی ترکین ( فصل ها). M.A. داستان شولوخوف ... سیاره ایمدلاتم. طیف نوری جذب و انتشار نور اتم ها. ترکیب هسته اتم. انرژی ... فصل 4 تمایز و خود سازماندهی ماده باریونی اولیه کیهانیسندمقدار اتم هادر 106 اتم هاسیلیکون، ... اندازه گیری ( سطح) انرژی; ... دینامیک گالیموف مدلبه خوبی توضیح می دهد ... 4.2.12-4.2. 13 روابط ارائه شده است ... به هم پیوسته سیاره ایسیستم ... الگوریتم تحلیل ارائه شده است در فصل ها 2 و 4. چگونه ... |
||||||||||||||||||||||||||||||||||||||||||
| بخوانید: |
|---|
محبوب:
لیست های توصیه شده ممکن است
|
جدید
- بانوی ما برای کسانی که قسم می خورند دعا نمی کند
- • صلیب ایمان قدیم چه تفاوتی با صلیب ارتدکس دارد؟
- الفبای روسی را با حروف بزرگ چاپ کنید و روی یک برگه چاپ کنید
- نشان لیاقت نظامی
- تسخیر Perekop توسط ارتش سرخ
- معنی Boretsk marfa در یک دایره المعارف مختصر زندگینامه
- رئیس هیئت مدیره Belarusbank Viktor Ananich در مورد مسائل همکاری بیشتر با مدیریت Belaruskali Board Belarusbank JSB گفتگو کرد.
- اگر در خواب خواب ببینید چه تعبیری دارد؟
- خشکسالی، سونامی، اقیانوس اطلس - مد برای بلایای آب فایل xml آب برای gta 5
- Grand theft auto iv: دوستان و دوست دخترها - تاکتیک های بازی و نکاتی از استادان کجاست میشل در GTA San Andreas


















 ,
, ,
, . بر اساس قانون سوم نیوتن، نیرویی برابر با f(اندازه آن برابر است و بر خلاف نیروی وارد بر الکترون است). اجازه دهید معادلات حرکت الکترون را بنویسیم
. بر اساس قانون سوم نیوتن، نیرویی برابر با f(اندازه آن برابر است و بر خلاف نیروی وارد بر الکترون است). اجازه دهید معادلات حرکت الکترون را بنویسیم
 .
.
 .
. .
. .
.
 .
.
 ,
, .
. .
. .
. .
. .
. .
.
 .
. .
. .
. ,
, .
. .
.
















 .
.

 :
: .
. erg
erg  eV،
eV، . بر این اساس، فرمول های (3.6) - (3.7) معنای بسیار محدودی دارند. با این وجود، همانطور که در زیر خواهیم دید، نتیجه نهایی (5.2) برای سطوح انرژی با حل معادله شرودینگر منطبق است. اگر اصلاحات نسبیتی ناچیز باشد، می توان از آن در همه موارد استفاده کرد.
. بر این اساس، فرمول های (3.6) - (3.7) معنای بسیار محدودی دارند. با این وجود، همانطور که در زیر خواهیم دید، نتیجه نهایی (5.2) برای سطوح انرژی با حل معادله شرودینگر منطبق است. اگر اصلاحات نسبیتی ناچیز باشد، می توان از آن در همه موارد استفاده کرد. ، نشان داده شده است
، نشان داده شده است  :
: سانتی متر
سانتی متر  .
. .
.
 .
. و آن را بر دوم تقسیم کنید. در نتیجه بدست می آوریم
و آن را بر دوم تقسیم کنید. در نتیجه بدست می آوریم
 .
. .
. تجزیه معتبر است
تجزیه معتبر است .
.


 به ازای هر جرم باقیمانده اتمی
به ازای هر جرم باقیمانده اتمی  ، که کمتر از جرم یک اتم است
، که کمتر از جرم یک اتم است  توسط جرم الکترون با استفاده از هویت به دست آمده از این
توسط جرم الکترون با استفاده از هویت به دست آمده از این