Bagian situs
Pilihan Editor:
- Tanda Efesus. Ucapan dari Kitab Suci, Kisah Konsili dan St. bapa, bahwa Roh Kudus hanya berasal dari Bapa, tetapi tidak berasal dari Anak. Interpretasi dalam Dalam
- Bunda Maria tidak berdoa bagi mereka yang bersumpah
- • Apa perbedaan salib Old Believer dengan salib Ortodoks?
- Cetak alfabet Rusia dengan huruf kapital dan cetak dalam satu lembar
- Perintah Kehormatan Militer
- Penangkapan Perekop oleh Tentara Merah
- Arti Boretsk marfa dalam ensiklopedia biografi singkat
- Ketua Dewan Belarusbank Viktor Ananich membahas masalah kerjasama lebih lanjut dengan manajemen Dewan Belaruskali JSB Belarusbank
- Jika bermimpi apa artinya jika anda bermimpi?
- Kekeringan, tsunami, Atlantik - mod untuk bencana air File xml air untuk gta 5
Periklanan
| Postulat Boron. Model atom planet Hubungan antara energi dan torsi |
|
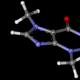
Apa ini? Ini adalah model atom Rutherford. Namanya diambil dari nama fisikawan Inggris kelahiran Selandia Baru, Ernest Rutherford, yang mengumumkan penemuan inti atom pada tahun 1911. Selama eksperimennya tentang hamburan partikel alfa pada kertas logam tipis, ia menemukan bahwa sebagian besar partikel alfa melewati langsung melalui kertas tersebut, namun ada pula yang memantul. Rutherford menyatakan bahwa di wilayah kecil tempat mereka memantul, terdapat inti bermuatan positif. Pengamatan ini membawanya untuk mendeskripsikan struktur atom, yang, dengan perubahan pada teori kuantum, masih diterima hingga saat ini. Sama seperti Bumi berputar mengelilingi Matahari, muatan listrik suatu atom terkonsentrasi di dalam inti, di mana elektron-elektron yang muatannya berlawanan mengorbit, dan medan elektromagnetik menjaga elektron-elektron tersebut tetap mengorbit di sekitar inti. Itu sebabnya model ini disebut planetary. Sebelum Rutherford, ada model atom lain - model materi Thompson. Ia tidak memiliki inti, ia adalah “kue” bermuatan positif yang diisi dengan “kismis” - elektron yang berputar bebas di dalamnya. Ngomong-ngomong, Thompson-lah yang menemukan elektron. DI DALAM sekolah modern ketika mereka mulai berkenalan, mereka selalu memulai dengan model ini. Model atom Rutherford (kiri) dan Thompson (kanan). //wikimedia.org Model kuantum yang saat ini menggambarkan struktur atom tentu saja berbeda dengan model yang dikemukakan Rutherford. Tidak ada mekanika kuantum dalam gerak planet mengelilingi Matahari, tetapi ada mekanika kuantum dalam gerak elektron mengelilingi inti. Namun konsep orbit masih tetap dalam teori struktur atom. Namun setelah diketahui bahwa orbitnya terkuantisasi, yaitu tidak ada transisi berkelanjutan di antara orbitnya, seperti yang dipikirkan Rutherford, tidak tepat jika menyebut model seperti itu sebagai planet. Rutherford mengambil langkah pertama ke arah yang benar, dan perkembangan teori struktur atom mengikuti jalur yang digariskannya. Mengapa hal ini menarik bagi sains? Eksperimen Rutherford menemukan inti atom. Tapi semua yang kita ketahui tentang mereka, kita pelajari nanti. Teorinya telah berkembang selama beberapa dekade dan berisi jawaban atas pertanyaan mendasar tentang struktur materi. Paradoks dengan cepat ditemukan dalam model Rutherford, yaitu: jika elektron bermuatan berputar mengelilingi inti, maka elektron tersebut akan memancarkan energi. Kita mengetahui bahwa suatu benda yang bergerak melingkar dengan kelajuan tetap tetap mengalami percepatan karena vektor kecepatannya selalu berubah. Dan jika partikel bermuatan bergerak dengan percepatan, ia akan memancarkan energi. Ini berarti dia akan segera kehilangan semuanya dan jatuh ke inti. Oleh karena itu, model atom klasik tidak sepenuhnya sesuai dengan dirinya sendiri. Kemudian mulai bermunculan teori-teori fisika yang mencoba mengatasi kontradiksi tersebut. Tambahan penting pada model struktur atom dibuat oleh Niels Bohr. Ia menemukan bahwa ada beberapa orbit kuantum di sekitar atom tempat elektron bergerak. Ia mengemukakan bahwa elektron tidak memancarkan energi sepanjang waktu, tetapi hanya ketika berpindah dari satu orbit ke orbit lainnya.
Model atom Bohr //wikimedia.org Dan setelah model atom Bohr, muncul prinsip ketidakpastian Heisenberg, yang akhirnya menjelaskan mengapa jatuhnya elektron ke dalam inti tidak mungkin terjadi. Heisenberg menemukan bahwa dalam atom yang tereksitasi, elektron berada pada orbit yang jauh, dan pada saat ia memancarkan foton, ia jatuh ke orbit utama, kehilangan energinya. Atom masuk ke keadaan stabil, di mana elektron akan berputar mengelilingi inti sampai tidak ada yang menggairahkannya dari luar. Ini adalah keadaan stabil, di luar itu elektron tidak akan jatuh. Karena keadaan dasar atom adalah keadaan stabil, materi ada, kita semua ada. Tanpa mekanika kuantum, kita tidak akan mempunyai materi yang stabil sama sekali. Dalam hal ini, pertanyaan utama yang mungkin ditanyakan oleh orang awam tentang mekanika kuantum adalah mengapa segala sesuatu tidak jatuh sama sekali? Mengapa semua hal tidak menyatu pada satu titik? Dan mekanika kuantum dapat menjawab pertanyaan ini. Mengapa mengetahui hal ini? Dalam arti tertentu, eksperimen Rutherford terulang kembali dengan ditemukannya quark. Rutherford menemukan bahwa muatan positif - proton - terkonsentrasi di dalam inti. Apa yang ada di dalam proton? Kita sekarang tahu bahwa ada quark di dalam proton. Kami mempelajari hal ini dengan melakukan percobaan serupa pada hamburan elektron-proton inelastis dalam pada tahun 1967 di SLAC (National Accelerator Laboratory, USA). Eksperimen ini dilakukan dengan prinsip yang sama dengan eksperimen Rutherford. Kemudian partikel alfa jatuh, dan di sini elektron jatuh ke proton. Akibat tumbukan tersebut, proton dapat tetap menjadi proton, atau dapat tereksitasi karena energinya yang tinggi, kemudian ketika proton dihamburkan, partikel lain, misalnya pi-meson, dapat lahir. Ternyata penampang melintang ini berperilaku seolah-olah terdapat komponen titik di dalam proton. Kita sekarang tahu bahwa komponen titik ini adalah quark. Dalam arti tertentu, ini adalah pengalaman Rutherford, tetapi pada tingkat berikutnya. Sejak tahun 1967, kita sudah memiliki model quark. Tapi kita tidak tahu apa yang akan terjadi selanjutnya. Sekarang Anda perlu menyebarkan sesuatu pada quark dan melihat apa yang mereka pecahkan. Tapi ini langkah selanjutnya, sejauh ini belum bisa dilakukan. Selain itu, kisah terpenting dari sejarah sains Rusia dikaitkan dengan nama Rutherford. Pyotr Leonidovich Kapitsa bekerja di laboratoriumnya. Pada awal tahun 1930-an, ia dilarang meninggalkan negaranya dan terpaksa tetap tinggal di Uni Soviet. Setelah mengetahui hal ini, Rutherford mengirimkan Kapitsa semua instrumen yang dia miliki di Inggris, dan dengan demikian membantu mendirikan Institut Masalah Fisika di Moskow. Artinya, berkat Rutherford, sebagian besar fisika Soviet terjadi. Model atom planet 19. Dalam model atom planet, diasumsikan bilangan 1) elektron dalam orbit sama dengan jumlah proton dalam inti 2) proton sama dengan jumlah neutron dalam inti 3) elektron dalam orbit sama dengan jumlah jumlah proton dan neutron dalam inti 4) neutron dalam inti sama dengan jumlah jumlah elektron dalam orbit dan jumlah proton dalam inti 21. Model atom planet dibenarkan oleh eksperimen 1) pembubaran dan peleburan padatan 2) ionisasi gas 3) produksi kimia zat baru 4) hamburan partikel 24. Model atom planet dapat dibenarkan 1) perhitungan pergerakan benda langit 2) percobaan elektrifikasi 3) percobaan hamburan partikel α 4) foto atom di mikroskop 44. Dalam percobaan Rutherford, partikel alfa tersebar 1) medan elektrostatik inti atom 2) kulit elektron atom target 3) medan gravitasi inti atom 4) permukaan sasaran 48. Dalam percobaan Rutherford, sebagian besar partikel α melewati foil dengan bebas, praktis tanpa menyimpang dari lintasan lurus, karena 1) inti atom mempunyai muatan positif 2) elektron mempunyai muatan negatif 3) inti atom mempunyai dimensi yang kecil (dibandingkan dengan atom). 4) Partikel α memiliki massa yang besar (dibandingkan dengan inti atom). 154. Pernyataan manakah yang sesuai dengan model atom planet? 1) Inti atom berada di tengah atom, muatan inti positif, elektron berada pada orbit mengelilingi inti. 2) Inti atom berada di tengah atom, muatan inti negatif, elektron berada pada orbit mengelilingi inti. 3) Elektron berada di pusat atom, inti berputar mengelilingi elektron, muatan inti positif. 4) Elektron berada di pusat atom, inti berputar mengelilingi elektron, muatan inti negatif. 225. Eksperimen E. Rutherford tentang hamburan partikel menunjukkan hal itu A. hampir seluruh massa atom terkonsentrasi di dalam inti atom. B. inti mempunyai muatan positif. Pernyataan manakah yang benar? 1) hanya A 2) hanya B 3) baik A maupun B 4) bukan A maupun B 259. Gagasan tentang struktur atom manakah yang sesuai dengan model atom Rutherford? 1) Inti berada di tengah atom, elektron berada pada orbit mengelilingi inti, muatan elektron positif. 2) Inti atom berada di pusat atom, elektron berada pada orbit mengelilingi inti, muatan elektron negatif. 3) Muatan positif tersebar merata ke seluruh atom, elektron-elektron dalam atom bergetar. 4) Muatan positif tersebar merata ke seluruh atom, dan elektron bergerak dalam atom dalam orbit yang berbeda. 266. Gagasan manakah tentang struktur atom yang benar? Sebagian besar massa atom terkonsentrasi 1) di dalam inti, muatan elektronnya positif 2) di dalam inti, muatan inti negatif 3) dalam elektron, muatan elektronnya negatif 4) dalam inti, muatan elektronnya negatif 254. Gagasan tentang struktur atom manakah yang sesuai dengan model atom Rutherford? 1) Inti atom berada di pusat atom, muatan inti positif, sebagian besar massa atom terkonsentrasi pada elektron. 2) Inti atom berada di tengah atom, muatan inti negatif, sebagian besar massa atom terkonsentrasi pada kulit elektron. 3) Inti - di pusat atom, muatan inti positif, sebagian besar massa atom terkonsentrasi di dalam inti. 4) Inti atom berada di pusat atom, muatan inti negatif, sebagian besar massa atom terkonsentrasi di dalam inti. postulat Bohr 267. Diagram tingkat energi terendah atom-atom gas atom yang dijernihkan berbentuk seperti pada gambar. Pada saat awal, atom berada dalam keadaan berenergi E (2) Menurut postulat Bohr, gas ini dapat memancarkan foton berenergi 1) 0,3 eV, 0,5 eV, dan 1,5 eV 2) 0,3 eV saja 3) 1,5 eV saja 4) apa pun yang berkisar antara 0 hingga 0,5 eV 273. Gambar tersebut menunjukkan diagram tingkat energi terendah suatu atom. Pada saat awal, atom berada dalam keadaan berenergi E (2). Menurut postulat Bohr, suatu atom dapat memancarkan foton dengan energi
1) 1 ∙ 10 -19 J 2) 3 ∙ 10 -19 J 3) 5 ∙ 10 -19 J 4) 6 ∙ 10 -19 J 279. Bagaimana frekuensi foton yang dipancarkan oleh suatu atom ditentukan menurut model atom Bohr? 1) perbedaan energi keadaan stasioner 2) frekuensi revolusi elektron mengelilingi inti 3) panjang gelombang de Broglie untuk elektron 4) model Bohr tidak memungkinkan penentuannya 15. Atom berada dalam keadaan dengan energi E 1< 0. Минимальная энергия, необходимая для отрыва электрона от атома, равна 1) 0 2) E 1 3) - E 1 4) - E 1 /2 16. Berapa banyak foton dengan frekuensi berbeda yang dapat dipancarkan oleh atom hidrogen pada keadaan tereksitasi kedua?
1) 1 2) 2 3) 3 4) 4 25. Mari kita asumsikan bahwa energi atom gas hanya dapat mengambil nilai yang ditunjukkan dalam diagram. Atom-atom berada dalam keadaan dengan energi e (3). Foton energi apa yang dapat diserap oleh gas ini?
1) apa pun dalam rentang dari 2 ∙ 10 -18 J hingga 8 ∙ 10 -18 J 2) apa pun, tetapi kurang dari 2 ∙ 10 -18 J 3) hanya 2 ∙ 10 -18 J 4) apa saja, lebih besar dari atau sama dengan 2 ∙ 10 -18 J 29. Ketika foton dengan energi 6 eV dipancarkan, muatan atom 1) tidak berubah 2) meningkat sebesar 9,6 ∙ 10 -19 C 3) bertambah 1,6 ∙ 10 -19 C 4) berkurang 9,6 ∙10 -19 C 30. Cahaya dengan frekuensi 4 ∙ 10 15 Hz terdiri dari foton dengan muatan listrik setara 1) 1,6 ∙ 10 -19 Cl 2) 6,4 ∙ 10 -19 Cl 3) 0 Cl 4) 6,4 ∙ 10 -4 Cl 78. Sebuah elektron pada kulit terluar suatu atom mula-mula berpindah dari keadaan diam dengan energi E 1 ke keadaan diam dengan energi E 2, menyerap foton dengan frekuensi ay 1. Kemudian ia berpindah dari keadaan E 2 ke keadaan diam dengan energi E 3, menyerap foton dengan frekuensi ay 2 > ay 1. Apa yang terjadi ketika elektron berpindah dari keadaan E 2 ke keadaan E 1. 1) emisi frekuensi cahaya ay 2 – ay 1 2) penyerapan cahaya berdasarkan frekuensi ay 2 – ay 1 3) emisi frekuensi cahaya ay 2 + ay 1 4) penyerapan cahaya berdasarkan frekuensi ay 2 – ay 1 90. Energi foton yang diserap oleh atom selama transisi dari keadaan dasar dengan energi E 0 ke keadaan tereksitasi dengan energi E 1 sama dengan (h - konstanta Planck)
95. Gambar tersebut menunjukkan tingkat energi suatu atom dan menunjukkan panjang gelombang foton yang dipancarkan dan diserap selama transisi dari satu tingkat ke tingkat lainnya. Berapa panjang gelombang foton yang dipancarkan selama transisi dari tingkat E 4 ke tingkat E 1, jika λ 13 = 400 nm, λ 24 = 500 nm, λ 32 = 600 nm? Nyatakan jawabanmu dalam nm dan bulatkan ke bilangan bulat.
96. Gambar tersebut menunjukkan beberapa tingkat energi kulit elektron suatu atom dan menunjukkan frekuensi foton yang dipancarkan dan diserap selama transisi antara tingkat-tingkat ini. Berapa panjang gelombang minimum foton yang dipancarkan oleh atom di setiap kemungkinan transisi antara level E 1, E 2, e s dan E 4, jika ay 13 = 7 ∙ 10 14 Hz, ay 24 = 5 ∙ 10 14 Hz, ay 32 = 3 ∙ 10 14Hz? Nyatakan jawabanmu dalam nm dan bulatkan ke bilangan bulat.
120. Gambar tersebut menunjukkan diagram tingkat energi suatu atom. Transisi antara tingkat energi yang ditandai dengan panah manakah yang disertai dengan penyerapan kuantum frekuensi minimum?
1) dari tingkat 1 ke tingkat 5 2) dari tingkat 1 ke tingkat 2 124. Gambar tersebut menunjukkan tingkat energi suatu atom dan menunjukkan panjang gelombang foton yang dipancarkan dan diserap selama transisi dari satu tingkat ke tingkat lainnya. Telah ditetapkan secara eksperimental bahwa panjang gelombang minimum foton yang dipancarkan selama transisi antara level ini adalah λ 0 = 250 nm. Berapakah nilai λ 13 jika λ 32 = 545 nm, λ 24 = 400 nm?
145. Gambar tersebut menunjukkan diagram kemungkinan nilai energi atom gas yang dijernihkan. Pada saat awal, atom berada dalam keadaan berenergi E (3). Gas mungkin saja memancarkan foton dengan energi
1) hanya 2 ∙ 10 -18 J 2) hanya 3 ∙ 10 -18 dan 6 ∙ 10 -18 J 3) hanya 2 ∙ 10 -18, 5 ∙ 10 -18 dan 8 ∙ 10 -18 J 4) mana saja dari 2 ∙ 10 -18 hingga 8 ∙ 10 -18 J 162. Tingkat energi elektron dalam atom hidrogen diberikan dengan rumus E n = - 13,6/n 2 eV, dengan n = 1, 2, 3, ... . Ketika sebuah atom bertransisi dari keadaan E 2 ke keadaan E 1, atom tersebut memancarkan foton. Begitu sampai di permukaan fotokatoda, foton mengeluarkan fotoelektron. Panjang gelombang cahaya yang sesuai dengan batas merah efek fotolistrik untuk material permukaan fotokatoda adalah λcr = 300 nm. Berapa kecepatan maksimum fotoelektron yang mungkin? 180. Gambar tersebut menunjukkan beberapa tingkat energi terendah dari atom hidrogen. Dapatkah atom dalam keadaan E 1 menyerap foton dengan energi 3,4 eV?
1) ya, dalam hal ini atom masuk ke keadaan E 2 2) ya, dalam hal ini atom masuk ke keadaan E 3 3) ya, dalam hal ini atom terionisasi, membusuk menjadi proton dan elektron 4) tidak, energi foton tidak cukup bagi atom untuk bertransisi ke keadaan tereksitasi 218. Gambar tersebut menunjukkan diagram sederhana tingkat energi suatu atom. Panah bernomor menunjukkan beberapa kemungkinan transisi atom antara level-level ini. Tetapkan korespondensi antara proses penyerapan cahaya dengan panjang gelombang terpanjang dan emisi cahaya dengan panjang gelombang terpanjang dan panah yang menunjukkan transisi energi atom. Untuk setiap posisi pada kolom pertama, pilih posisi yang sesuai di kolom kedua dan tuliskan nomor yang dipilih pada tabel di bawah huruf yang sesuai.
226. Gambar tersebut menunjukkan potongan diagram tingkat energi atom. Transisi antara tingkat energi yang ditandai dengan panah manakah yang disertai dengan emisi foton dengan energi maksimum?
1) dari tingkat 1 ke tingkat 5 2) dari tingkat 5 ke tingkat 2 3) dari tingkat 5 ke tingkat 1 4) dari tingkat 2 ke tingkat 1 228. Gambar tersebut menunjukkan empat tingkat energi atom hidrogen yang lebih rendah. Transisi manakah yang berhubungan dengan penyerapan foton dengan energi 12,1 eV oleh sebuah atom?
1)E 3 → E 1 2) E 1 → E 3 3)E 3 →E 2 4) E 1 → E 4 238. Sebuah elektron dengan momentum p = 2 ∙ 10 -24 kg ∙ m/s bertabrakan dengan proton yang diam, membentuk atom hidrogen dalam keadaan berenergi E n (n = 2). Selama pembentukan atom, foton dipancarkan. Temukan frekuensinya ay foton ini, mengabaikan energi kinetik atom. Tingkat energi elektron dalam atom hidrogen diberikan oleh rumus dimana n =1,2, 3, .... 260. Diagram tingkat energi terendah suatu atom berbentuk seperti pada gambar. Pada saat awal, atom berada dalam keadaan berenergi E (2). Menurut postulat Bohr, atom dapat memancarkan foton dengan energi 1) hanya 0,5 eV 2) hanya 1,5 eV 3) kurang dari 0,5 eV 4) dalam kisaran 0,5 hingga 2 eV 269. Gambar tersebut menunjukkan diagram tingkat energi suatu atom. Nomor berapa yang menunjukkan transisi yang sesuai radiasi foton dengan energi paling rendah?
1) 1 2) 2 3) 3 4) 4 282. Emisi foton oleh atom terjadi ketika 1) pergerakan elektron dalam orbit stasioner 2) peralihan elektron dari keadaan dasar ke keadaan tereksitasi 3) transisi elektron dari keadaan tereksitasi ke keadaan dasar 4) semua proses yang terdaftar 13. Emisi foton terjadi selama transisi dari keadaan tereksitasi dengan energi E 1 > E 2 > E 3 ke keadaan dasar. Untuk frekuensi foton yang bersesuaian v 1, v 2, v 3, hubungannya valid 1) ay 1 < ay 2 < ay 3 2) ay 2 < ay 1 < ay 3 3) ay 2 < ay 3 < ay 1 4) ay 1 > ay 2 > ay 3 1) lebih besar dari nol 2) sama dengan nol 3) kurang dari nol 4) lebih atau kurang dari nol tergantung pada negara bagian 98. Sebuah atom dalam keadaan diam menyerap foton dengan energi 1,2 ∙ 10 -17 J. Dalam hal ini, momentum atom 1) tidak berubah 2) menjadi sama dengan 1,2 ∙ 10 -17 kg ∙ m/s 3) menjadi sama dengan 4 ∙ 10 -26 kg ∙ m/s 4) menjadi sama dengan 3,6 ∙ 10 -9 kg ∙ m/s 110. Misalkan diagram tingkat energi atom suatu zat tertentu berbentuk, ditunjukkan pada gambar, dan atom-atom berada dalam keadaan dengan energi E (1). Sebuah elektron yang bergerak dengan energi kinetik 1,5 eV bertabrakan dengan salah satu atom ini dan memantul, memperoleh sejumlah energi tambahan. Tentukan momentum elektron setelah tumbukan, dengan asumsi atom dalam keadaan diam sebelum tumbukan. Abaikan kemungkinan atom memancarkan cahaya ketika bertabrakan dengan elektron. 111. Misalkan diagram tingkat energi atom-atom suatu zat tertentu berbentuk seperti pada gambar, dan atom-atom tersebut berada dalam keadaan berenergi E (1). Sebuah elektron yang bertabrakan dengan salah satu atom ini memantul, memperoleh sejumlah energi tambahan. Momentum elektron setelah tumbukan dengan atom yang diam ternyata sama dengan 1,2 ∙ 10 -24 kg ∙ m/s. Tentukan energi kinetik elektron sebelum tumbukan. Abaikan kemungkinan atom memancarkan cahaya ketika bertabrakan dengan elektron. 136. Meson π° dengan massa 2,4 ∙ 10 -28 kg meluruh menjadi dua kuanta. Temukan besarnya momentum salah satu kuanta yang dihasilkan dalam kerangka acuan di mana meson primer π ° diam. 144. Bejana tersebut berisi atom hidrogen yang dijernihkan. Sebuah atom hidrogen dalam keadaan dasar (E 1 = - 13,6 eV) menyerap foton dan terionisasi. Sebuah elektron yang dipancarkan dari suatu atom akibat ionisasi menjauh dari inti dengan kecepatan v = 1000 km/s. Berapa frekuensi foton yang diserap? Abaikan energi gerak termal atom hidrogen. 197. Sebuah atom hidrogen yang diam dalam keadaan dasar (E 1 = - 13,6 eV) menyerap foton dalam ruang hampa dengan panjang gelombang = 80 nm. Pada kecepatan berapa elektron yang dipancarkan dari atom akibat ionisasi menjauh dari inti? Abaikan energi kinetik ion yang terbentuk. 214. Sebuah pion bebas (π° meson) dengan energi diam 135 MeV bergerak dengan kecepatan v, yang jauh lebih kecil dari kecepatan cahaya. Akibat peluruhannya, terbentuklah dua kuanta, salah satunya merambat searah dengan gerak pion, dan yang lainnya berlawanan arah. Energi satu kuantum 10% lebih besar dari kuantum lainnya. Berapa kecepatan pion sebelum meluruh? 232. Tabel menunjukkan nilai energi tingkat energi kedua dan keempat atom hidrogen.
Berapa energi foton yang dipancarkan atom selama transisi dari tingkat keempat ke tingkat kedua? 1) 5,45 ∙ 10 -19 J 2) 1,36 ∙ 10 -19 J 3) 6,81 ∙ 10 -19 J 4) 4,09 ∙ 10 -19 J 248. Sebuah atom dalam keadaan diam memancarkan foton dengan energi 16,32 ∙ 10 -19 J sebagai akibat transisi elektron dari keadaan tereksitasi ke keadaan dasar. Akibat recoil, atom mulai bergerak translasi berlawanan arah dengan energi kinetik 8,81 10 -27 J. Tentukan massa atom. Kecepatan atom dianggap kecil dibandingkan kecepatan cahaya. 252. Bejana tersebut berisi atom hidrogen yang dijernihkan. Sebuah atom hidrogen dalam keadaan dasar (E 1 = -13,6 eV) menyerap foton dan terionisasi. Sebuah elektron yang dipancarkan dari suatu atom akibat ionisasi menjauh dari inti dengan kecepatan 1000 km/s. Berapa panjang gelombang foton yang diserap? Abaikan energi gerak termal atom hidrogen. 1) 46 nm 2) 64 nm 3) 75 nm 4) 91 nm 257. Bejana tersebut berisi atom hidrogen yang dijernihkan. Sebuah atom hidrogen dalam keadaan dasar (E 1 = -13,6 eV) menyerap foton dan terionisasi. Sebuah elektron yang dipancarkan dari suatu atom akibat ionisasi menjauh dari inti dengan kecepatan v = 1000 km/s. Berapa energi foton yang diserap? Abaikan energi gerak termal atom hidrogen. 1) 13,6 eV 2) 16,4 eV 3) 19,3 eV 4) 27,2 eV 1 | | | | Moskow universitas negeri Statistika Ekonomi Ilmu Komputer Abstrak tentang disiplin: "KSE" pada topik tersebut : "Model atom planet" Selesai: siswa tahun ke-3 Grup DNF-301 Ruziev Temur Guru: Mosolov D.N. Moskow 2008 Teori atom pertama Dalton berasumsi bahwa dunia terdiri dari sejumlah atom - bahan penyusun dasar - dengan sifat karakteristik yang abadi dan tidak berubah. Cakupan yang sangat besar karya ilmiah Rutherford di Montreal - ia menerbitkan 66 artikel baik secara pribadi maupun bersama-sama dengan ilmuwan lain, tidak termasuk buku "Radioaktivitas" - membuat Rutherford terkenal sebagai peneliti kelas satu. Dia menerima undangan untuk mengambil kursi di Manchester. Pada tanggal 24 Mei 1907, Rutherford kembali ke Eropa. Dimulai periode baru hidupnya. Upaya pertama untuk membuat model atom berdasarkan akumulasi data eksperimen dilakukan oleh J. Thomson (1903). Ia percaya bahwa atom adalah sistem bola yang netral secara listrik dengan radius kira-kira 10-10 m. Muatan positif atom didistribusikan secara merata ke seluruh volume bola, dan elektron bermuatan negatif terletak di dalamnya. Untuk menjelaskan garis spektrum emisi atom, Thomson mencoba menentukan letak elektron dalam atom dan menghitung frekuensi getarannya di sekitar posisi kesetimbangan. Namun, upaya ini tidak berhasil. Beberapa tahun kemudian, dalam eksperimen fisikawan besar Inggris E. Rutherford, terbukti bahwa model Thomson salah. Fisikawan Inggris E. Rutherford menyelidiki sifat radiasi ini. Ternyata pancaran radiasi radioaktif dalam medan magnet kuat terbagi menjadi tiga bagian: radiasi a-, b- dan y. sinar b melambangkan aliran elektron, sinar a melambangkan inti atom helium, dan sinar y melambangkan radiasi elektromagnetik gelombang pendek. Fenomena radioaktivitas alam menunjukkan kompleksnya struktur atom. Pada tahun 1913, Niels Bohr menerbitkan hasil refleksi dan perhitungan yang panjang, yang paling penting dikenal sebagai postulat Bohr: dalam sebuah atom selalu ada sejumlah besar orbit yang stabil dan ditentukan secara ketat di mana elektron dapat melaju tanpa batas, karena semua gaya yang bekerja padanya ternyata seimbang; Sebuah elektron dapat berpindah dalam sebuah atom hanya dari satu orbit stabil ke orbit lain yang sama stabilnya. Jika selama transisi seperti itu elektron menjauh dari inti, maka dari luar perlu diberikan sejumlah energi tertentu yang sama dengan perbedaan cadangan energi elektron di orbit atas dan bawah. Jika sebuah elektron mendekati inti, ia “membuang” kelebihan energi dalam bentuk radiasi… Postulat pertama:
Postulat kedua:
Postulat ketiga:
1.dari keadaan stasioner dasar ke keadaan tereksitasi,
2.dari keadaan stasioner tereksitasi ke keadaan dasar. Postulat Bohr bertentangan dengan hukum fisika klasik. Mereka mengungkapkan fitur karakteristik microworld - sifat kuantum dari fenomena yang terjadi di sana. Kesimpulan berdasarkan postulat Bohr sesuai dengan eksperimen. Misalnya, mereka menjelaskan pola spektrum atom hidrogen, asal usul spektrum karakteristik sinar-X, dan lain-lain. Pada Gambar. Gambar 3 menunjukkan bagian diagram energi keadaan stasioner atom hidrogen. Panah menunjukkan transisi atom yang menyebabkan emisi energi. Dapat dilihat bahwa garis spektral digabungkan menjadi seri, berbeda dalam tingkat transisi atom dari tingkat lain (yang lebih tinggi). Mengetahui perbedaan antara energi elektron dalam orbit-orbit ini, adalah mungkin untuk membuat kurva yang menggambarkan spektrum emisi hidrogen dalam berbagai keadaan tereksitasi dan menentukan panjang gelombang berapa yang harus mudah dipancarkan oleh atom hidrogen jika kelebihan energi disuplai dari luar, misalnya menggunakan lampu merkuri terang. Kurva teoretis ini sepenuhnya bertepatan dengan spektrum emisi atom hidrogen tereksitasi yang diukur oleh ilmuwan Swiss J. Balmer pada tahun 1885! Sastra yang digunakan:
Stabilitas sistem apa pun pada skala atom mengikuti prinsip ketidakpastian Heisenberg (bagian keempat dari bab ketujuh). Oleh karena itu, studi yang konsisten tentang sifat-sifat atom hanya mungkin dilakukan dalam kerangka teori kuantum. Namun, beberapa hasil itu penting signifikansi praktis, juga dapat diperoleh dalam kerangka mekanika klasik dengan mengadopsi aturan kuantisasi orbital tambahan. Dalam bab ini, kita akan menghitung posisi tingkat energi atom hidrogen dan ion mirip hidrogen. Perhitungannya didasarkan pada model planet, yang menurutnya elektron berputar mengelilingi inti di bawah pengaruh gaya tarik menarik Coulomb. Kami berasumsi bahwa elektron bergerak dalam orbit melingkar. 13.1. Prinsip korespondensiKuantisasi momentum sudut digunakan dalam model atom hidrogen yang dikemukakan oleh Bohr pada tahun 1913. Bohr berangkat dari fakta bahwa dalam batas kuanta energi kecil, hasil teori kuantum harus sesuai dengan kesimpulan mekanika klasik. Dia merumuskan tiga postulat. Sebuah atom hanya dapat bertahan lama dalam keadaan tertentu dengan tingkat energi diskrit E Saya . Elektron, yang berputar pada orbit diskrit yang sesuai, bergerak dengan percepatan, namun tetap tidak memancar. (Dalam elektrodinamika klasik, setiap partikel yang bergerak dipercepat akan meradiasi jika muatannya bukan nol). Radiasi dipancarkan atau diserap oleh kuanta selama transisi antar tingkat energi:  Dari postulat ini mengikuti aturan untuk mengkuantisasi momentum sudut sebuah elektron
Di mana N bisa sama dengan bilangan asli apa pun: Parameter N ditelepon bilangan kuantum utama. Untuk menurunkan rumus (1.1), kita menyatakan energi suatu tingkat dalam bentuk torsi. Pengukuran astronomi memerlukan pengetahuan tentang panjang gelombang dengan akurasi yang cukup tinggi: enam angka yang benar untuk jalur optik dan hingga delapan angka yang benar untuk jalur radio. Oleh karena itu, ketika mempelajari atom hidrogen, asumsi massa inti yang sangat besar ternyata terlalu kasar, karena menyebabkan kesalahan pada bilangan keempat. angka penting. Pergerakan inti perlu diperhitungkan. Untuk mempertimbangkan hal tersebut, konsep tersebut diperkenalkan pengurangan massa. 13.2. Mengurangi massaSebuah elektron bergerak mengelilingi inti di bawah pengaruh gaya elektrostatis
Di mana R- vektor yang awalnya berimpit dengan posisi inti, dan ujungnya mengarah ke elektron. Izinkan kami mengingatkan Anda akan hal itu Z adalah nomor atom inti, dan muatan inti serta elektron masing-masing sama Ze Dan
Mari kita perkenalkan variabel baru: kecepatan elektron relatif terhadap inti
dan kecepatan pusat massa
Menambahkan (2.2a) dan (2.2b), kita peroleh
Dengan demikian, pusat massa sistem tertutup bergerak secara seragam dan lurus. Sekarang mari kita bagi (2.2b) dengan M Z dan kurangi dari (2.2a), dibagi M e. Hasilnya adalah persamaan kecepatan relatif elektron:
Jumlah yang termasuk di dalamnya
ditelepon pengurangan massa. Dengan demikian, masalah gerak gabungan dua partikel - elektron dan inti - disederhanakan. Cukup dengan memperhatikan pergerakan mengelilingi inti suatu partikel, yang posisinya bertepatan dengan posisi elektron, dan massanya sama dengan massa tereduksi sistem. 13.3. Hubungan antara energi dan torsiGaya interaksi Coulomb diarahkan sepanjang garis lurus yang menghubungkan muatan-muatan, dan modulusnya hanya bergantung pada jarak R di antara mereka. Akibatnya, persamaan (2.5) menggambarkan gerak partikel dalam medan simetris terpusat. Sifat penting gerak dalam medan dengan simetri pusat adalah kekekalan energi dan torsi. Mari kita tuliskan syarat bahwa gerak elektron dalam orbit melingkar ditentukan oleh gaya tarik Coulomb terhadap inti:
Oleh karena itu energi kinetik
sama dengan setengah energi potensial
diambil dengan tanda sebaliknya:
Energi Total E, masing-masing, sama dengan:
Ternyata hasilnya negatif, sebagaimana seharusnya terjadi pada negara-negara yang stabil. Keadaan atom dan ion yang berenergi negatif disebut terkait. Mengalikan persamaan (3.4) dengan 2 R dan mengganti produk di sisi kiri MVR pada saat rotasi M, mari kita nyatakan kecepatannya V sebentar lagi:
Mengganti nilai kecepatan yang dihasilkan ke (3,5), kita memperoleh rumus yang diperlukan untuk energi total:
Mari kita perhatikan fakta bahwa energi sebanding dengan kekuatan torsi yang genap. Dalam teori Bohr, fakta ini mempunyai konsekuensi penting. 13.4. Kuantisasi torsiPersamaan kedua untuk variabel V Dan R kita peroleh dari aturan kuantisasi orbit, yang penurunannya akan dilakukan berdasarkan postulat Bohr. Membedakan rumus (3.5), kita memperoleh hubungan antara perubahan kecil torsi dan energi:
Menurut postulat ketiga, frekuensi foton yang dipancarkan (atau diserap) sama dengan frekuensi revolusi elektron dalam orbit:
Dari rumus (3.4), (4.2) dan hubungannya
Antara kecepatan, torsi, dan jari-jari, berikut ekspresi sederhana untuk perubahan momentum sudut selama transisi elektron antara orbit yang berdekatan:
Mengintegrasikan (4.3), kita peroleh Konstan C kami akan mencari dalam interval setengah terbuka
Ketimpangan ganda (4.5) tidak menimbulkan batasan tambahan apa pun: jika DENGAN melampaui batas (4.5), maka dapat dikembalikan ke interval ini hanya dengan memberi nomor ulang nilai momen pada rumus (4.4). Hukum fisika adalah sama di semua sistem referensi. Mari beralih dari sistem koordinat tangan kanan ke sistem koordinat tangan kiri. Energi, seperti besaran skalar lainnya, akan tetap sama,
Vektor torsi aksial berperilaku berbeda. Seperti diketahui, setiap vektor aksial berubah tanda saat melakukan operasi yang ditunjukkan: Tidak ada kontradiksi antara (4.6) dan (4.7), karena energi menurut (3.7) berbanding terbalik dengan kuadrat momen dan tetap sama ketika tanda berubah. M. Jadi, himpunan nilai torsi negatif harus mengulangi himpunan nilai positifnya. Dengan kata lain, untuk setiap nilai positif M N harus ada nilai negatif yang sama dengan nilai absolutnya M – M : Menggabungkan (4.4) – (4.8), kita memperoleh persamaan linier untuk DENGAN:
dengan solusi
Sangat mudah untuk memverifikasi bahwa rumus (4.9) memberikan dua nilai konstanta DENGAN, memuaskan ketimpangan (4.5):
Hasil yang diperoleh diilustrasikan dengan tabel yang menunjukkan deret momen untuk tiga nilai C: 0, 1/2 dan 1/4. Terlihat jelas pada baris terakhir ( N=1/4) nilai torsi untuk nilai positif dan negatif N berbeda dalam nilai absolutnya. Bohr berhasil mendapatkan persetujuan dengan data eksperimen dengan menetapkan konstanta C sama dengan nol. Kemudian aturan kuantisasi momentum orbital dijelaskan dengan rumus (1). Namun juga mempunyai arti dan makna C sama dengan setengah. Ini menggambarkan momen batin elektron, atau itu putaran- sebuah konsep yang akan dibahas secara rinci di bab lain. Model atom planet sering disajikan dimulai dengan rumus (1), tetapi secara historis model ini diturunkan dari prinsip korespondensi. 13.5. Parameter orbital elektronRumus (1.1) dan (3.7) menghasilkan himpunan jari-jari orbital dan kecepatan elektron yang terpisah, yang dapat dinomori ulang menggunakan bilangan kuantum N: Mereka sesuai dengan spektrum energi diskrit. Energi elektron total E N dapat dihitung dengan menggunakan rumus (3.5) dan (5.1):
Kami telah memperoleh serangkaian keadaan energi terpisah dari atom hidrogen atau ion mirip hidrogen. Nyatakan sesuai dengan nilainya N sama dengan satu disebut utama, orang lain - bersemangat, bagaimana kalau N
sangat besar, lalu - sangat bersemangat. Gambar 13.5.1 mengilustrasikan rumus (5.2) untuk atom hidrogen. Garis putus-putus kondisi. Mendekati batas ionisasi, tingkat pada Gambar 13.5.2 secara bertahap menjadi lebih padat. Pada bab pertama kami memperkenalkan Rydberg berdasarkan pertimbangan dimensi. Rumus (5.2) mengungkapkan arti fisis dari konstanta ini sebagai satuan pengukuran energi atom yang mudah digunakan. Selain itu, hal ini menunjukkan bahwa Ry bergantung pada relasinya
Karena perbedaan besar antara massa inti dan elektron, ketergantungan ini sangat lemah, namun dalam beberapa kasus tidak dapat diabaikan. Pembilang rumus terakhir mengandung konstanta
dimana nilai Ry cenderung dengan peningkatan massa inti yang tidak terbatas. Jadi, kami telah memperjelas satuan pengukuran Ry yang diberikan di bab pertama. Aturan kuantisasi momen (1.1), tentu saja, kurang akurat dibandingkan ekspresi (12.6.1) untuk nilai eigen operator Jadi, menurut model atom planet, dalam keadaan terikat, kecepatan rotasi, jari-jari orbital, dan energi elektron mengambil serangkaian nilai diskrit dan sepenuhnya ditentukan oleh nilai bilangan kuantum utama. Serikat dengan energi positif ditelepon bebas; mereka tidak terkuantisasi, dan semua parameter elektron di dalamnya, kecuali momen rotasi, dapat mengambil nilai apa pun yang tidak bertentangan dengan hukum kekekalan. Torsi selalu terkuantisasi. Rumus model planet memungkinkan untuk menghitung potensi ionisasi atom hidrogen atau ion mirip hidrogen, serta panjang gelombang transisi antar keadaan dengan arti yang berbeda N. Anda juga dapat memperkirakan ukuran atom, kecepatan linier dan sudut elektron pada orbitnya. Rumus turunan mempunyai dua keterbatasan. Pertama, mereka tidak memperhitungkan efek relativistik, yang menghasilkan kesalahan urutan ( V/C) 2 . Koreksi relativistik meningkat seiring dengan meningkatnya muatan inti Z 4 dan untuk ion FeXXVI sudah sepersekian persen. Di akhir bab ini, kita akan mempertimbangkan efek ini, sambil tetap berada dalam kerangka model planet. Kedua, selain bilangan kuantum N energi level ditentukan oleh parameter lain - orbital dan momen internal elektron. Oleh karena itu, level-level tersebut dibagi menjadi beberapa sublevel. Besaran pembagiannya juga proporsional Z 4 dan menjadi nyata untuk ion berat. Semua fitur level diskrit diperhitungkan dalam teori kuantum yang konsisten. Namun demikian, teori sederhana Bohr ternyata merupakan metode yang sederhana, nyaman dan cukup akurat untuk mempelajari struktur ion dan atom. 13.6.Konstanta RydbergDalam rentang spektrum optik, bukan energi kuantum yang biasanya diukur E, dan panjang gelombang adalah transisi antar level. Oleh karena itu, bilangan gelombang sering digunakan untuk mengukur tingkat energi E/hc, diukur dalam sentimeter terbalik. Nomor gelombang sesuai
Indeks mengingatkan kita bahwa massa inti dalam definisi ini dianggap sangat besar. Dengan mempertimbangkan massa inti yang terbatas, konstanta Rydberg sama dengan
Untuk inti yang berat, jumlahnya lebih besar daripada inti yang ringan. Perbandingan massa proton dan elektron adalah Mengganti nilai ini ke (2.2) kita memperoleh ekspresi numerik untuk konstanta Rydberg untuk atom hidrogen: Inti dari isotop berat hidrogen - deuterium - terdiri dari proton dan neutron, dan kira-kira dua kali lebih berat dari inti atom hidrogen - proton. Oleh karena itu, menurut (6.2), konstanta Rydberg untuk deuterium R D lebih besar dari hidrogen R H: Bahkan lebih tinggi lagi untuk isotop hidrogen yang tidak stabil - tritium, yang intinya terdiri dari satu proton dan dua neutron. Untuk unsur-unsur yang berada di tengah tabel periodik, efek pergeseran isotop bersaing dengan efek yang terkait dengan ukuran inti yang terbatas. Efek-efek ini memiliki tanda yang berlawanan dan saling meniadakan unsur-unsur yang dekat dengan kalsium. 13.7. Urutan isoelektronik hidrogenMenurut definisi yang diberikan pada bagian keempat bab ketujuh, ion yang terdiri dari inti dan satu elektron disebut mirip hidrogen. Dengan kata lain, mereka mengacu pada urutan isoelektronik hidrogen. Strukturnya secara kualitatif mengingatkan pada atom hidrogen, dan posisi tingkat energi ion yang muatan intinya tidak terlalu besar ( Z Z > 20), perbedaan kuantitatif muncul terkait dengan efek relativistik: ketergantungan massa elektron pada kecepatan dan interaksi spin-orbit. Kita akan melihat ion paling menarik dalam astrofisika: helium, oksigen, dan besi. Dalam spektroskopi, muatan suatu ion ditentukan menggunakan simbol spektroskopi, yang ditulis dengan angka Romawi di sebelah kanan lambang unsur kimia. Angka yang diwakili oleh angka romawi adalah satu lebih besar dari jumlah elektron yang dilepaskan dari atom. Misalnya, atom hidrogen dilambangkan sebagai HI, dan ion helium, oksigen, dan besi yang mirip hidrogen masing-masing adalah HeII, OVIII, dan FeXXVI. Untuk ion multielektron, simbol spektroskopi bertepatan dengan muatan efektif yang “dirasakan” oleh elektron valensi. Mari kita menghitung pergerakan elektron dalam orbit melingkar dengan mempertimbangkan ketergantungan relativistik massanya pada kecepatan. Persamaan (3.1) dan (1.1) dalam kasus relativistik terlihat seperti ini:
Mengurangi massa M ditentukan oleh rumus (2.6). Mari kita juga mengingat hal itu
Kalikan persamaan pertama dengan
Konstanta struktur halus diperkenalkan dalam rumus (2.2.1) pada bab pertama. Mengetahui kecepatannya, kami menghitung jari-jari orbit:
Dalam teori relativitas khusus, energi kinetik sama dengan selisih antara energi total suatu benda dan energi diamnya tanpa adanya medan gaya eksternal:
Energi potensial kamu sebagai sebuah fungsi R ditentukan oleh rumus (3.3). Mengganti ke dalam ekspresi untuk T Dan kamu nilai yang diperoleh dan R, kita memperoleh energi total elektron: Untuk elektron yang berputar pada orbit pertama ion besi mirip hidrogen, nilai 2 adalah 0,04. Oleh karena itu, untuk elemen yang lebih ringan, jumlahnya bahkan lebih sedikit. Pada
Suku pertama, mudah dilihat, setara, hingga notasi, dengan nilai energi (5.2) dalam teori non-relativistik Bohr, dan suku kedua mewakili koreksi relativistik yang diinginkan. Mari kita nyatakan istilah pertama sebagai E B, kalau begitu
Mari kita tuliskan ekspresi eksplisit untuk koreksi relativistik:
Jadi, nilai relatif koreksi relativistik sebanding dengan hasil kali 2 Z 4. Mempertimbangkan ketergantungan massa elektron pada kecepatan menyebabkan peningkatan kedalaman level. Hal ini dapat dipahami sebagai berikut: nilai absolut energi meningkat seiring dengan bertambahnya massa partikel, dan elektron yang bergerak lebih berat daripada elektron yang diam. Melemahnya efek dengan meningkatnya bilangan kuantum N merupakan konsekuensi dari pergerakan elektron yang lebih lambat dalam keadaan tereksitasi. Ketergantungan yang kuat pada Z merupakan konsekuensi dari tingginya kecepatan elektron dalam medan inti yang bermuatan besar. Di masa depan, kita akan menghitung besaran ini sesuai dengan aturan mekanika kuantum dan memperoleh hasil baru - penghapusan degenerasi momentum orbital. 13.8. Negara-negara yang sangat bersemangatKeadaan atom atau ion suatu unsur kimia yang salah satu elektronnya berada pada level tinggi tingkat energi, ditelepon sangat bersemangat, atau Rydbergia. Mereka memiliki sifat penting: posisi tingkat elektron tereksitasi dapat digambarkan dengan akurasi yang cukup tinggi dalam kerangka model Bohr. Faktanya adalah elektron dengan bilangan kuantum besar N, menurut (5.1), sangat jauh dari inti dan elektron lainnya. Dalam spektroskopi, elektron semacam itu biasanya disebut “optik” atau “valensi”, dan elektron yang tersisa bersama inti disebut “residu atom”. Struktur skema atom dengan satu elektron tereksitasi tinggi ditunjukkan pada Gambar 13.8.1. Di kiri bawah adalah atom
sisanya: inti dan elektron dalam keadaan dasar. Panah putus-putus menunjukkan elektron valensi. Jarak antara semua elektron dalam residu atom jauh lebih kecil daripada jarak salah satu elektron ke elektron optik. Oleh karena itu, muatan totalnya dapat dianggap hampir seluruhnya terkonsentrasi di pusat. Oleh karena itu, kita dapat berasumsi bahwa elektron optik bergerak di bawah pengaruh gaya Coulomb yang diarahkan ke inti, dan tingkat energinya dihitung menggunakan rumus Bohr (5.2). Elektron dari residu atom melindungi inti, tetapi tidak sepenuhnya. Untuk memperhitungkan penyaringan parsial, konsep tersebut diperkenalkan muatan efektif residu atom Z efektif. Dalam kasus elektron yang sangat jauh, nilainya Z eff sama dengan selisih nomor atom suatu unsur kimia Z dan jumlah elektron residu atom. Di sini kita membatasi diri pada kasus atom netral, yang mana Z efek = 1. Posisi tingkat tereksitasi tinggi diperoleh dalam teori Bohr untuk atom apa pun. Cukup dengan mengganti pada (2.6)
kita dapat menyatakan konstanta Rydberg sebagai fungsi berat atom A unsur kimia yang dimaksud:
planet modelatom... + --- a -- = 0; (2.12) h² h ∂t 4πm ∂а а Δβ + 2(lulusan аgradβ) – ----- = 0. (2. 13 ) h ∂t Untuk βh φ = -- (2.14) 2πm Madelung diperoleh persamaan... Bab 1 Nukleon dan Inti AtomDokumenAkan ditampilkan di bab 8, magnetis... Rutherford pada tahun 1911 planetmodelatom, Ilmuwan Belanda A. Van... mengalami peningkatan yang nyata tingkatenergi. Inti dengan neutron... terkandung selulosa 13 atom oksigen, 34 atom hidrogen dan 3 atom karbon,... Program Pendidikan Gimnasium Lembaga Pendidikan Anggaran Negara Nomor 625 Tahun Pelajaran 2012/13Program pendidikan utamaPromosi tingkat kualifikasi, kompetensi dan tingkat pembayaran... Ujian Negara : 46 46 13 20 13 - 39 7 ... Puisi “Vasily Terkin” ( bab). MA. Kisah Sholokhov... Planetmodelatom. Spektrum optik. Penyerapan dan emisi cahaya atom. Komposisi inti atom. Energi ... Bab 4 Diferensiasi dan pengorganisasian mandiri materi baryon kosmik primerDokumenKuantitas atom di 106 atom silikon, ... mengukur ( tingkat) energi; ... Galimov dinamis model menjelaskan dengan baik... 4.2.12-4.2. 13 hubungan disajikan... saling berhubungan planet sistem... algoritma analisis disajikan di bab 2 dan 4. Bagaimana... |
||||||||||||||||||||||||||||||||||||||||||
| Membaca: |
|---|
Populer:
Baru
- Bunda Maria tidak berdoa bagi mereka yang bersumpah
- • Apa perbedaan salib Old Believer dengan salib Ortodoks?
- Cetak alfabet Rusia dengan huruf kapital dan cetak dalam satu lembar
- Perintah Kehormatan Militer
- Penangkapan Perekop oleh Tentara Merah
- Arti Boretsk marfa dalam ensiklopedia biografi singkat
- Ketua Dewan Belarusbank Viktor Ananich membahas masalah kerjasama lebih lanjut dengan manajemen Dewan Belaruskali JSB Belarusbank
- Jika bermimpi apa artinya jika anda bermimpi?
- Kekeringan, tsunami, Atlantik - mod untuk bencana air File xml air untuk gta 5
- Grand theft auto iv: teman dan pacar - taktik permainan dan tip dari master Di mana Michelle di GTA San Andreas


















 ,
, ,
, . Menurut hukum ketiga Newton, gaya yang bekerja pada inti sama dengan - F(besarnya sama dan arahnya berlawanan dengan gaya yang bekerja pada elektron). Mari kita tuliskan persamaan gerak elektron
. Menurut hukum ketiga Newton, gaya yang bekerja pada inti sama dengan - F(besarnya sama dan arahnya berlawanan dengan gaya yang bekerja pada elektron). Mari kita tuliskan persamaan gerak elektron
 .
.
 .
. .
. .
.
 .
.
 ,
, .
. .
. .
. .
. .
. .
.
 .
. .
. .
. ,
, .
. .
.
















 .
.

 :
: .
. misalnya
misalnya  eV,
eV, . Oleh karena itu, rumus (3.6) – (3.7) memiliki arti yang sangat terbatas. Namun demikian, seperti yang akan kita lihat di bawah, hasil akhir (5.2) untuk tingkat energi sama dengan penyelesaian persamaan Schrödinger. Ini dapat digunakan dalam semua kasus jika koreksi relativistik dapat diabaikan.
. Oleh karena itu, rumus (3.6) – (3.7) memiliki arti yang sangat terbatas. Namun demikian, seperti yang akan kita lihat di bawah, hasil akhir (5.2) untuk tingkat energi sama dengan penyelesaian persamaan Schrödinger. Ini dapat digunakan dalam semua kasus jika koreksi relativistik dapat diabaikan. , dilambangkan
, dilambangkan  :
: cm
cm  .
. .
.
 .
. dan membaginya dengan detik. Hasilnya kita dapatkan
dan membaginya dengan detik. Hasilnya kita dapatkan
 .
. .
. dekomposisi tersebut valid
dekomposisi tersebut valid .
.


 per massa residu atom
per massa residu atom  , yang lebih kecil dari massa atom
, yang lebih kecil dari massa atom  oleh massa elektron. Menggunakan identitas yang diperoleh dari ini
oleh massa elektron. Menggunakan identitas yang diperoleh dari ini