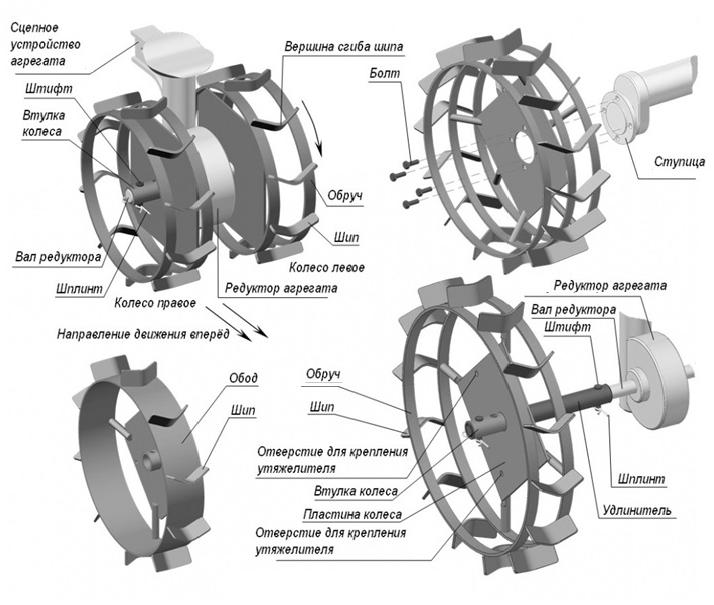
Bagian situs web
Pilihan Editor:
- Gagasan untuk mendekorasi kamar dengan kupu-kupu kertas
- Fitur, jenis, metode penerapan plester Venesia dekoratif
- Fitur, jenis, metode penerapan plester Venesia dekoratif
- Waterproofing karet cair untuk lantai kayu
- Cara memperbaiki kamar mandi di Khrushchev
- Linoleum mana yang lebih baik untuk rumah: atas dasar apa linoleum lebih baik Linoleum mana yang harus diletakkan di rumah
- Ubin kamar mandi modis
- Melindungi dinding kayu dari panasnya tungku
- Isolasi untuk dinding eksterior rumah: mana yang harus dipilih Isolasi untuk dinding luar
- Cara merekat wallpaper cair dengan tangan Anda sendiri
Iklan
| Pembakaran homogen dan heterogen. Teori pembakaran heterogen |
|
membakar ledakan oksigen Pembakaran gas-gas pra-campur mengacu pada homogen. Banyak contoh pembakaran homogen adalah pembakaran gas atau uap dimana oksigen adalah zat pengoksidasi: pembakaran campuran hidrogen, campuran karbon monoksida dan hidrokarbon dengan udara. Dalam kasus yang praktis penting, kondisi pencampuran pendahuluan yang lengkap tidak selalu puas. Oleh karena itu, kombinasi pembakaran homogen dengan jenis pembakaran lainnya selalu memungkinkan. Pembakaran homogen dapat diimplementasikan dalam dua mode: laminar dan turbulen. Turbulensi mempercepat proses pembakaran karena fragmentasi bagian depan nyala menjadi fragmen individu dan, dengan demikian, peningkatan area kontak zat bereaksi selama turbulensi skala besar atau percepatan proses perpindahan panas dan massa di bagian depan nyala pada skala kecil. Kesamaan diri melekat dalam pembakaran turbulen: pusaran turbulen meningkatkan laju pembakaran, yang mengarah pada peningkatan turbulensi. Semua parameter pembakaran homogen juga dimanifestasikan dalam proses di mana gas lain bertindak bukan sebagai zat pengoksidasi. Misalnya, fluor, klor atau brom. Pembakaran heterogen terjadi pada antarmuka. Dalam hal ini, salah satu zat yang bereaksi dalam keadaan terkondensasi, yang lain (biasanya oksigen atmosfer) berasal dari difusi fase gas. Prasyarat untuk pembakaran heterogen adalah titik didih yang sangat tinggi (atau dekomposisi) fase terkondensasi. Jika kondisi ini tidak terpenuhi, pembakaran didahului dengan penguapan atau penguraian. Dari permukaan, aliran uap atau produk penguraian gas memasuki zona pembakaran, dan pembakaran terjadi dalam fase gas. Pembakaran tersebut dapat dikaitkan dengan difusi kuasi-heterogen, tetapi tidak sepenuhnya heterogen, karena proses pembakaran tidak lagi terjadi pada batas fase. Pengembangan pembakaran tersebut dilakukan karena fluks panas dari nyala api ke permukaan material, yang memberikan penguapan lebih lanjut atau dekomposisi dan aliran bahan bakar ke zona pembakaran. Dalam situasi seperti itu, suatu kasus campuran muncul ketika reaksi pembakaran sebagian berjalan secara heterogen - pada permukaan fase terkondensasi, sebagian secara homogen - dalam volume campuran gas. Contoh pembakaran heterogen adalah pembakaran batubara dan arang. Ketika zat-zat ini terbakar, reaksi dari dua jenis terjadi. Beberapa varietas batubara mengeluarkan komponen yang mudah menguap ketika dipanaskan. Pembakaran batubara semacam itu didahului oleh dekomposisi termal parsialnya dengan melepaskan hidrokarbon gas dan hidrogen, yang terbakar dalam fase gas. Selain itu, ketika karbon murni dibakar, karbon monoksida CO dapat terbentuk, yang terbakar dalam volume. Dengan kelebihan udara yang cukup dan suhu tinggi permukaan batubara, reaksi volume berlangsung sangat dekat dengan permukaan sehingga, dengan perkiraan tertentu, itu memberikan alasan untuk mempertimbangkan proses semacam itu heterogen. Contoh pembakaran yang benar-benar heterogen adalah pembakaran logam non-volatil yang tahan api. Proses-proses ini dapat menjadi rumit dengan pembentukan oksida yang menutupi permukaan yang terbakar dan mencegah kontak dengan oksigen. Dengan perbedaan besar dalam sifat fisikokimia antara logam dan oksida selama pembakaran, film oksida retak, dan oksigen diizinkan memasuki zona pembakaran. Berdasarkan contoh yang dipertimbangkan, tergantung pada keadaan agregasi campuran bahan bakar dan pengoksidasi, yaitu pada jumlah fase dalam campuran, bedakan: 1. Pembakaran homogen gas dan uap bahan yang mudah terbakar di lingkungan agen pengoksidasi gas. Dengan demikian, reaksi pembakaran berlangsung dalam suatu sistem yang terdiri dari satu fase (keadaan agregasi). 2. Pembakaran heterogen zat yang mudah terbakar dalam media pengoksidasi gas. Dalam hal ini, reaksi berlangsung pada antarmuka, sedangkan reaksi homogen terjadi di seluruh volume. Ini adalah pembakaran logam, grafit, mis. bahan praktis tidak mudah menguap. Banyak reaksi gas bersifat heterogen homogen, ketika kemungkinan reaksi homogen disebabkan oleh terjadinya reaksi heterogen serentak. Pembakaran semua zat cair dan banyak zat padat yang darinya uap atau gas (zat mudah menguap) dilepaskan hasil dalam fase gas. Fase padat dan cair memainkan peran reservoir produk reaktif. Sebagai contoh, reaksi heterogen dari pembakaran spontan batubara masuk ke fase homogen pembakaran zat volatil. Residu kokas terbakar secara heterogen. 4.3. Difusi dan pembakaran kinetik.Menurut tingkat persiapan campuran yang mudah terbakar, difusi dan pembakaran kinetik dibedakan. Jenis-jenis pembakaran yang dipertimbangkan (kecuali untuk bahan peledak) berhubungan dengan pembakaran difusi. Nyala, mis. zona pembakaran campuran bahan bakar dengan udara, untuk memastikan stabilitas, harus secara konstan diumpankan dengan bahan bakar dan oksigen. Aliran gas yang mudah terbakar hanya bergantung pada laju pasokannya ke zona pembakaran. Laju aliran cairan yang mudah terbakar tergantung pada intensitas penguapannya, yaitu. dari tekanan uap di atas permukaan cairan, dan, karenanya, dari suhu cairan. Titik nyala disebut suhu cairan terendah di mana nyala api di atas permukaannya tidak padam. Pembakaran padatan berbeda dari pembakaran gas dengan adanya tahap dekomposisi dan gasifikasi, diikuti oleh pengapian produk pirolisis yang mudah menguap. Pirolisis- Ini adalah pemanasan zat organik hingga suhu tinggi tanpa udara. Dalam hal ini, dekomposisi, atau pemisahan, dari senyawa kompleks menjadi yang lebih sederhana (kokas batubara, retak minyak, distilasi kering pohon) terjadi. Oleh karena itu, pembakaran zat mudah terbakar padat dalam produk pembakaran tidak terkonsentrasi hanya di zona nyala, tetapi memiliki karakter multi-tahap. Pemanasan fase padat menyebabkan dekomposisi dan evolusi gas, yang terbakar dan terbakar. Panas dari obor memanaskan fase padat, menyebabkan gasifikasi dan proses berulang, sehingga mendukung pembakaran. Model pembakaran padat mengasumsikan keberadaan fase-fase berikut (Gbr. 17): Ara. 17. Model pembakaran benda padat. pemanasan fase padat. Zat leleh di zona ini mengalami leleh. Ketebalan zona tergantung pada suhu konduktivitas zat; pirolisis, atau zona reaksi dalam fase padat, di mana zat-zat mudah terbakar berbentuk gas terbentuk; pra-nyala dalam fase gas, di mana campuran dengan zat pengoksidasi terbentuk; nyala api, atau zona reaksi dalam fase gas, di mana konversi produk pirolisis menjadi produk gas dari pembakaran; produk pembakaran. Tingkat pasokan oksigen ke zona pembakaran tergantung pada difusi melalui produk pembakaran. Secara umum, karena laju reaksi kimia di zona pembakaran pada jenis pembakaran yang dipertimbangkan tergantung pada tingkat kedatangan komponen yang bereaksi dan permukaan nyala oleh difusi molekuler atau kinetik, jenis pembakaran ini disebut difusi. Struktur api pembakaran difusi terdiri dari tiga zona (Gbr. 18): Di zona 1 ada gas atau uap. Pembakaran tidak terjadi di zona ini. Suhu tidak melebihi 500 0 Dec. Dekomposisi, pirolisis volatil, dan pemanasan terjadi pada suhu pembakaran sendiri.
Ara. 18. Struktur nyala api. Di zona 2, campuran uap (gas) dengan oksigen atmosfer terbentuk dan pembakaran tidak sempurna terhadap CO terjadi dengan reduksi parsial menjadi karbon (oksigen rendah): C n H m + O 2 → CO + CO 2 + H 2 O; Di 3 zona luar, produk-produk dari zona kedua sepenuhnya terbakar dan suhu nyala maksimum diamati: 2CO + O 2 \u003d 2CO 2; Tinggi nyala sebanding dengan koefisien difusi dan laju aliran gas dan berbanding terbalik dengan kerapatan gas. Semua jenis pembakaran difusi melekat dalam kebakaran. Kinetispembakaran adalah pembakaran gas mudah terbakar pra-campuran, uap atau debu dengan zat pengoksidasi. Dalam hal ini, laju pembakaran hanya bergantung pada sifat fisikokimia dari campuran yang mudah terbakar (konduktivitas termal, kapasitas panas, turbulensi, konsentrasi zat, tekanan, dll.). Oleh karena itu, laju pembakaran meningkat tajam. Jenis pembakaran ini melekat dalam ledakan. DI Ara. 19. Pola distribusi nyala api dalam campuran yang mudah terbakar: - sumber penyalaan; - Arah gerakan depan api. Meskipun, jika Anda mencampur gas yang mudah terbakar dengan udara dan memasukkannya ke dalam pembakar, selama nyala api nyala stasioner terbentuk, asalkan laju umpan campuran sama dengan kecepatan perambatan nyala api. Jika laju aliran gas dinaikkan, nyala api menjauh dari pembakar dan mungkin padam. Dan jika kecepatannya dikurangi, nyala api akan masuk ke bagian dalam burner dengan kemungkinan ledakan. Menurut tingkat pembakaran, yaitu kelengkapan proses reaksi pembakaran terhadap produk akhir, pembakaran terjadi lengkap dan tidak lengkap. Jadi di zona 2 (Gbr. 18), pembakaran tidak sempurna, karena oksigen tidak cukup dipasok, yang sebagian dikonsumsi di zona 3, dan produk antara terbentuk. Yang terakhir terbakar di zona 3, di mana ada lebih banyak oksigen, untuk menyelesaikan pembakaran. Kehadiran jelaga dalam asap menunjukkan pembakaran tidak sempurna. Contoh lain: dengan kekurangan oksigen, karbon terbakar menjadi karbon monoksida: Jika Anda menambahkan O, maka reaksinya berakhir: 2CO + O 2 \u003d 2CO 2. Tingkat pembakaran tergantung pada sifat pergerakan gas. Oleh karena itu, pembakaran laminar dan turbulen dibedakan. Jadi, contoh pembakaran laminar adalah nyala lilin di udara diam. Di pembakaran laminar lapisan gas mengalir secara paralel tetapi tanpa berputar-putar. Pembakaran bergolak - Gerakan pusaran gas, di mana gas pembakaran dicampur secara intensif, dan bagian depan nyala api terkikis. Batas antara tipe-tipe ini adalah kriteria Reynolds, yang mencirikan hubungan antara gaya inersia dan gaya gesekan dalam aliran:
dimana: - laju aliran gas; - viskositas kinetik; l- ukuran linier karakteristik. Angka Reynolds di mana transisi dari lapisan batas laminar ke yang bergolak disebut kritis Re cr, Re cr ~ 2320. Turbulensi meningkatkan laju pembakaran karena perpindahan panas yang lebih intens dari produk pembakaran ke campuran segar. Media mudah terbakar Zat pengoksidasi Zat pengoksidasi adalah zat yang atomnya mengambil elektron dalam transformasi kimia. Di antara zat-zat sederhana, mereka termasuk semua halogen dan oksigen. Zat pengoksidasi yang paling umum di alam adalah oksigen atmosfer. Dalam kebakaran nyata, pembakaran terutama terjadi di udara, namun, banyak proses teknologi menggunakan udara yang diperkaya oksigen dan bahkan oksigen murni (misalnya, produksi metalurgi, pengelasan gas, pemotongan, dll.). Atmosfer yang diperkaya dengan oksigen dapat ditemukan di bawah air dan pesawat ruang angkasa, proses domain, dll. Sistem yang mudah terbakar tersebut memiliki bahaya kebakaran yang meningkat. Ini harus diperhitungkan ketika mengembangkan sistem pemadam kebakaran, langkah-langkah pencegahan kebakaran dan keahlian teknis kebakaran. Selain oksigen atmosfer dan halogen, zat kompleks dapat bertindak sebagai zat pengoksidasi dalam reaksi pembakaran, misalnya, garam asam yang mengandung oksigen - nitrat, klorat, dll., Digunakan dalam pembuatan serbuk mesiu, bahan peledak militer dan industri, dan berbagai komposisi piroteknik. Campuran bahan bakar dan pengoksidasi dalam keadaan agregasi yang sama di proporsi tertentu dan mampu terbakar (dan pembakaran hanya mungkin dengan rasio tertentu), disebut media yang mudah terbakar. Ada dua jenis media yang mudah terbakar: homogen dan heterogen. Media mudah terbakar homogen disebut campuran bahan bakar yang sudah dicampur dengan bahan pengoksidasi, dan, karenanya media mudah terbakar heterogen – ketika bahan bakar dan oksidator tidak tercampur. Dampak pada proses pembakaran sejumlah besar faktor menentukan keragaman jenis dan mode pembakaran. Jadi, tergantung pada keadaan agregasi komponen dari campuran yang mudah terbakar, pembakaran dapat bersifat homogen dan heterogen, pada kondisi pencampuran komponen, pembakaran campuran yang telah disiapkan sebelumnya (kinetik) dan difusi, pada kondisi gas-dinamis, laminar dan turbulen, dll. Jenis utama pembakaran adalah homogen dan heterogen. Pembakaran homogen -
itu adalah proses interaksi dan bahan bakar Pembakaran heterogen - ini adalah pembakaran bahan yang mudah terbakar padat - Seperti dapat dilihat dari definisi, perbedaan mendasar antara pembakaran homogen dan heterogen adalah bahwa dalam kasus pertama, bahan bakar dan zat pengoksidasi berada dalam keadaan agregasi yang sama, dalam yang kedua - dalam yang berbeda. Perlu dicatat bahwa pembakaran padatan dan material tidak selalu heterogen. Ini karena mekanisme pembakaran padatan. Jadi, misalnya, membakar kayu di udara. Untuk menyalakannya, perlu membawa semacam sumber panas, misalnya nyala api dari korek api atau korek api, dan tunggu sebentar. Timbul pertanyaan: mengapa tidak segera menyala? Ini karena pada periode awal, sumber penyalaan harus memanaskan kayu pada suhu tertentu di mana proses pirolisis dimulai, atau dengan kata lain, dekomposisi termal. Dalam hal ini, sebagai hasil dekomposisi selulosa dan komponen lainnya, produk dari dekomposisi mereka - gas yang mudah terbakar - hidrokarbon, mulai dilepaskan. Jelas, semakin besar pemanasan, semakin besar laju dekomposisi dan, karenanya, laju emisi gas yang mudah terbakar. Dan hanya pada saat itu, ketika laju pelepasan GH akan cukup untuk menciptakan konsentrasi tertentu di udara, mis. pembentukan media yang mudah terbakar, pembakaran dapat terjadi. Apa yang pembakaran bukanlah kayu, tetapi produk penguraiannya - gas yang mudah terbakar. Itulah sebabnya pembakaran kayu, dalam banyak kasus, adalah pembakaran homogen, dan tidak heterogen. Anda dapat berdebat: kayu, pada akhirnya, mulai membara, dan membara, seperti yang disebutkan di atas, adalah pembakaran yang heterogen. Begitulah. Faktanya adalah bahwa produk akhir dari penguraian kayu terutama gas yang mudah terbakar dan residu karbon, yang disebut coke. Ini adalah residu paling berkarbon yang Anda lihat dan bahkan dibeli untuk persiapan barbecue. Batubara ini sekitar 98% karbon murni dan tidak dapat menghasilkan GH. Batubara terbakar sudah dalam mode pembakaran yang heterogen, yaitu, mereka membara. Dengan demikian, kayu terbakar pertama kali dalam mode pembakaran homogen, kemudian, pada suhu sekitar 800 ° C, nyala api membusuk, yaitu. menjadi heterogen. Ini juga terjadi dengan padatan lainnya. Bagaimana cairan terbakar di udara? Mekanisme pembakaran cairan adalah yang pertama menguap, dan uaplah yang membentuk campuran yang mudah terbakar dengan udara. Artinya, dalam hal ini, pembakaran homogen juga terjadi. bukan fase cair terbakar, tetapi uap cair Mekanisme pembakaran logam adalah sama dengan cairan, kecuali bahwa logam harus terlebih dahulu dilebur dan kemudian dipanaskan hingga suhu tinggi sehingga laju penguapan cukup untuk pembentukan media yang mudah terbakar. Beberapa logam terbakar di permukaannya. Dalam pembakaran homogen, dua rezim dibedakan: pembakaran kinetik dan difusi. Pembakaran kinetik - ini adalah pembakaran campuran yang mudah terbakar pra-campuran, mis. campuran homogen. Laju pembakaran hanya ditentukan oleh kinetika reaksi redoks. Pembakaran difusi - ini adalah pembakaran campuran yang tidak homogen ketika bahan bakar dan zat pengoksidasi tidak dicampur terlebih dahulu, yaitu heterogen. Dalam hal ini, pencampuran bahan bakar dan oksidator terjadi di depan api karena difusi. Untuk pembakaran yang tidak terorganisir, ini adalah mode difusi pembakaran yang merupakan karakteristik, sebagian besar bahan yang mudah terbakar dalam api hanya dapat terbakar dalam mode ini. Campuran homogen, tentu saja, juga dapat dibentuk dalam api sungguhan, tetapi pembentukannya lebih mungkin didahului oleh api atau memberikan tahap awal pengembangan. Perbedaan mendasar antara jenis-jenis pembakaran ini adalah bahwa dalam campuran yang homogen, molekul bahan bakar dan pengoksidasi sudah berada dalam jarak yang dekat dan siap untuk memasuki interaksi kimia, sementara pembakaran difusi, molekul-molekul ini harus lebih dekat satu sama lain karena difusi, dan hanya setelah itu masuk dalam interaksi. Ini menyebabkan perbedaan dalam tingkat proses pembakaran. Total waktu pembakaran tg adalah jumlah dari durasi fisik t g = t f + t x. Mode pembakaran kinetik dicirikan oleh durasi hanya proses kimia, yaitu t g »t x, karena dalam hal ini tidak diperlukan proses persiapan fisik (pencampuran), yaitu. t f »0 . Mode pembakaran difusi, sebaliknya, terutama tergantung pada Jika t f »t x, mis. mereka sepadan, kemudian hasil pembakaran jadi Sebagai contoh, bayangkan dua pembakar gas (Gbr. 1.1): di salah satu di nozzle ada bukaan untuk akses udara (a), di yang lain tidak (b). Dalam kasus pertama, udara akan tersedot dengan injeksi ke nozzle, di mana ia dicampur menjadi gas yang mudah terbakar, sehingga membentuk campuran yang mudah terbakar homogen, yang terbakar di pintu keluar nozzle ke mode kinetik . Dalam kasus kedua (b), udara dicampur dengan gas yang mudah terbakar selama pembakaran karena difusi, dalam hal ini - pembakaran difusi . Ara. 1.1 Contoh pembakaran kinetik (a) dan difusi (b) Contoh lain: ada kebocoran gas di dalam ruangan. Gas secara bertahap dicampur dengan udara, membentuk campuran mudah terbakar yang seragam. Dan jika sumber pengapian muncul setelah ini, ledakan terjadi. Ini adalah pembakaran dalam mode kinetik. Begitu pula saat membakar cairan, seperti bensin. Jika dituangkan ke dalam wadah terbuka dan dibakar, pembakaran difusi akan terjadi. Jika Anda menempatkan wadah ini di ruang tertutup dan menunggu beberapa saat, bensin akan menguap sebagian, bercampur dengan udara dan dengan demikian membentuk campuran mudah terbakar yang homogen. Ketika Anda memperkenalkan sumber pengapian, seperti yang Anda tahu, ledakan akan terjadi, ini adalah pembakaran kinetik. Dalam mode apa pembakaran terjadi pada kebakaran nyata? Tentu saja, terutama dalam difusi. Dalam beberapa kasus, api dapat dimulai dengan pembakaran kinetik, seperti pada contoh yang diberikan, setelah campuran seragam terbakar, yang terjadi sangat cepat, pembakaran akan berlanjut dalam mode difusi. Selama pembakaran difusi, dalam kasus kekurangan oksigen, misalnya, selama kebakaran di ruang tertutup, pembakaran bahan bakar tidak sempurna dimungkinkan dengan pembentukan produk pembakaran tidak lengkap seperti CO - karbon monoksida. Semua produk dari pembakaran yang tidak lengkap sangat beracun dan menimbulkan bahaya besar dalam kebakaran. Dalam kebanyakan kasus, merekalah yang bertanggung jawab atas kematian. Jadi, jenis utama pembakaran adalah homogen dan heterogen. Perbedaan visual antara mode-mode ini adalah adanya nyala api. Pembakaran homogen dapat terjadi dalam dua mode: difusi dan kinetik. Secara visual, perbedaan mereka terletak pada laju pembakaran. Perlu dicatat bahwa jenis pembakaran lain dibedakan - pembakaran bahan peledak. Bahan peledak termasuk bahan bakar dan zat pengoksidasi dalam fase padat. Karena bahan bakar dan oksidator berada dalam keadaan agregat yang sama, pembakaran seperti itu homogen. Pada kebakaran nyata, sebagian besar pembakaran nyala terjadi. Api, seperti yang Anda tahu, memancarkan sebagai salah satu faktor api yang berbahaya. Apa itu nyala api dan proses apa yang terjadi di dalamnya? Saat membakar bahan bakar padat, reaksi kimia itu sendiri didahului dengan proses memasok zat pengoksidasi ke permukaan yang bereaksi. Oleh karena itu, proses pembakaran bahan bakar padat adalah proses fisikokimia heterogen yang kompleks, yang terdiri dari dua tahap: pasokan oksigen ke permukaan bahan bakar dengan difusi turbulen dan molekuler dan reaksi kimia di atasnya. Pertimbangkan teori umum pembakaran heterogen menggunakan contoh pembakaran partikel karbon bulat, dengan mengambil kondisi berikut. Konsentrasi oksigen di seluruh permukaan partikel adalah sama; laju reaksi oksigen dengan karbon sebanding dengan konsentrasi oksigen di permukaan, yaitu, reaksi orde pertama terjadi, yang paling mungkin untuk proses heterogen; reaksi berlangsung pada permukaan partikel dengan pembentukan produk pembakaran akhir, dan tidak ada reaksi sekunder dalam volume, serta pada permukaan partikel. Dalam lingkungan yang disederhanakan, laju pembakaran karbon dapat direpresentasikan sebagai tergantung pada kecepatan dua tahap utamanya, yaitu, laju pasokan oksigen ke permukaan antarmuka dan laju reaksi kimia yang berlangsung pada permukaan partikel. Sebagai hasil dari interaksi proses-proses ini, keadaan kesetimbangan dinamis terjadi antara jumlah yang dikirimkan oleh difusi dan dihabiskan untuk reaksi kimia oksigen pada nilai konsentrasi tertentu pada permukaan karbon. Laju reaksi kimia / (° 2 g oksigen / (cm2-s), ditentukan Karena jumlah oksigen yang dikonsumsi oleh satu unit permukaan reaksi per unit waktu, dapat dinyatakan sebagai berikut: Dalam persamaan: K adalah konstanta laju reaksi kimia; St adalah konsentrasi oksigen di permukaan partikel. Di sisi lain, laju pembakaran sama dengan fluks ki spesifik Oksigen ke permukaan reaktif yang dihasilkan oleh difusi: K ° "\u003d neraka (C, - C5). (15-2) Dalam persamaan: Neraka - koefisien pertukaran difusi; Co adalah konsentrasi oksigen dalam aliran di mana partikel karbon terbakar. Mengganti nilai Cb yang ditemukan dari persamaan (15-1) menjadi persamaan (15-2), kita memperoleh ungkapan berikut untuk laju pembakaran heterogen melalui jumlah oksigen yang dikonsumsi oleh permukaan unit dari partikel per satuan waktu: ". °, ■ '(15-3) Pelabelan oleh Kkazh - - Ts -, (15-4) Ekspresi (15-3) dapat direpresentasikan sebagai /<°’ = /СкажС„. (15-5) Dalam strukturnya, ekspresi (15-5) mirip dengan persamaan kinetik (15-1) dari reaksi orde pertama. Di dalamnya, konstanta laju reaksi ξ digantikan oleh koefisien Kkaz, yang tergantung baik pada reaksi - sifat bahan bakar dan pada hukum transportasi dan oleh karena itu disebut konstanta nyata dari laju pembakaran karbon padat. Laju reaksi pembakaran kimia tergantung pada sifat bahan bakar dan kondisi fisik: konsentrasi gas yang bereaksi pada permukaan, suhu dan tekanan. Ketergantungan suhu pada laju reaksi kimia adalah yang terkuat. Pada suhu rendah, laju reaksi kimia rendah dan konsumsi oksigennya jauh lebih rendah daripada laju oksigen yang dihasilkan melalui difusi. Proses pembakaran dibatasi oleh laju reaksi kimia itu sendiri dan tidak tergantung pada kondisi pasokan. oksigen, mis., kecepatan udara, ukuran partikel, dll. Oleh karena itu, area pembakaran heterogen ini disebut kinetik. Di daerah pembakaran kinetik, neraka\u003e - £, oleh karena itu, dalam rumus (15-3) nilai 1 / jam dapat diabaikan dibandingkan dengan 1 / & dan kemudian kita akan mendapatkan: K ° 32 \u003d kC0. (15-6) Kesetimbangan antara jumlah yang dikirim oleh difusi dan oksigen yang dikonsumsi dalam reaksi ditetapkan dengan gradien kecil konsentrasi, karena konsentrasi oksigen pada permukaan reaksi sedikit berbeda dari nilainya dalam aliran. Pada suhu tinggi, pembakaran kinetik dapat terjadi pada laju aliran udara yang tinggi dan partikel bahan bakar ukuran kecil, yaitu, dengan peningkatan dalam kondisi untuk memasok oksigen, ketika yang terakhir dapat dikirim dalam jumlah yang jauh lebih besar daripada kebutuhan akan reaksi kimia. Area yang berbeda selama pembakaran heterogen digambarkan secara grafik pada Gambar. 15-1. Wilayah kinetik I ditandai oleh kurva 1, yang menunjukkan bahwa dengan meningkatnya suhu, laju pembakaran meningkat tajam menurut hukum Arrhenius. Pada suhu tertentu, laju reaksi kimia menjadi sebanding dengan laju pengiriman oksigen ke permukaan reaksi, dan kemudian laju pembakaran menjadi tergantung tidak hanya pada laju reaksi kimia, tetapi juga pada laju pengiriman oksigen. Di wilayah ini, disebut perantara (Gambar 15-1, wilayah II, kurva 1-2), laju aliran dari kedua tahap ini sebanding, tidak ada yang dapat diabaikan dan karenanya laju proses pembakaran ditentukan oleh rumus (15-3). Dengan meningkatnya suhu, laju pembakaran meningkat, tetapi pada tingkat yang lebih rendah daripada di wilayah kinetik, dan pertumbuhannya secara bertahap melambat dan akhirnya mencapai maksimum saat transisi ke daerah difus (Gbr. 15-1, wilayah III, kurva 2-3), tetap tidak tergantung pada suhu. Pada suhu yang lebih tinggi di wilayah ini, laju reaksi kimia meningkat sedemikian rupa sehingga oksigen yang dikirim oleh difusi langsung masuk ke dalam reaksi kimia, akibatnya konsentrasi oksigen di permukaan praktis sama dengan nol. Dalam rumus (15-3), nilai 1 / & dapat diabaikan dibandingkan dengan 1 / neraka, maka kita akan menemukan bahwa laju pembakaran ditentukan oleh laju difusi oksigen ke permukaan reaksi, mis. Dan daerah terbakar ini disebut difusi. Di daerah difusi, laju pembakaran praktis tidak tergantung pada sifat bahan bakar dan suhu. Efek suhu hanya memengaruhi perubahan konstanta fisik. Di daerah ini, laju pembakaran sangat dipengaruhi oleh kondisi pengiriman oksigen, yaitu faktor hidrodinamik: kecepatan relatif dari aliran gas dan ukuran partikel bahan bakar. Dengan peningkatan laju aliran gas dan penurunan ukuran partikel, yaitu, dengan pengiriman oksigen dipercepat, laju pembakaran difusi meningkat. Selama pembakaran, keseimbangan dinamis terbentuk antara proses kimia konsumsi oksigen dan proses difusi pengirimannya pada konsentrasi oksigen tertentu pada permukaan reaksi. Konsentrasi oksigen pada permukaan partikel tergantung pada rasio laju kedua proses ini, dengan prevalensi laju difusi, ia akan mendekati konsentrasi dalam aliran, sementara peningkatan laju reaksi kimia menyebabkannya menurun. Proses pembakaran yang terjadi di daerah difusi dapat masuk ke antara (kurva 1 "-2") atau bahkan ke daerah kinetik ketika difusi ditingkatkan, misalnya, dengan peningkatan kecepatan aliran atau penurunan ukuran partikel. Dengan demikian, dengan peningkatan laju aliran gas dan dengan transisi ke partikel kecil, proses bergeser ke arah pembakaran kinetik. Peningkatan suhu menggeser proses menuju pembakaran difusi (Gbr. 15-1, kurva 2 "-3"). Terjadinya pembakaran heterogen di area tertentu untuk kasus tertentu tergantung pada kondisi spesifik ini. Tugas utama mempelajari proses pembakaran heterogen adalah untuk menetapkan area pembakaran dan identifikasi pola kuantitatif untuk setiap area. Fenomena fisik yang tercantum dalam bagian sebelumnya diamati dalam berbagai proses, yang berbeda dalam sifat reaksi kimia dan dalam keadaan agregasi zat yang terlibat dalam pembakaran. Ada pembakaran homogen, heterogen dan difusi. Pembakaran gas-gas pra-campur mengacu pada homogen. Banyak contoh pembakaran homogen adalah pembakaran gas atau uap dimana oksigen adalah zat pengoksidasi: pembakaran campuran hidrogen, campuran karbon monoksida dan hidrokarbon dengan udara. Dalam kasus yang praktis penting), kondisi pencampuran pendahuluan yang lengkap tidak selalu puas. Oleh karena itu, kombinasi pembakaran homogen dengan jenis pembakaran lainnya selalu memungkinkan. Pembakaran homogen dapat diwujudkan dalam dua mode laminar dan turbulen. Turbulensi mempercepat proses pembakaran karena fragmentasi bagian depan nyala menjadi fragmen individu dan, seiring dengan itu, peningkatan area kontak zat bereaksi selama turbulensi skala besar atau percepatan perpindahan panas dan massa di bagian depan nyala pada skala kecil. Kesamaan diri melekat dalam pembakaran turbulen: pusaran turbulen meningkatkan laju pembakaran, yang mengarah pada peningkatan turbulensi. Semua parameter pembakaran homogen juga dimanifestasikan dalam proses di mana gas lain bertindak bukan sebagai zat pengoksidasi. Misalnya, fluor, klor atau brom. Pada kebakaran, pembakaran difusi adalah yang paling umum. Di dalamnya, semua reaktan berada dalam fase gas, tetapi tidak dicampur sebelumnya. Dalam hal membakar cairan zat padat, proses oksidasi bahan bakar dalam fase gas terjadi bersamaan dengan proses penguapan cairan (atau dekomposisi bahan padat) dan proses pencampuran. Contoh paling sederhana dari pembakaran difusi adalah pembakaran gas alam dalam kompor gas. Dalam kebakaran, rezim pembakaran difusi turbulen diwujudkan, ketika laju pembakaran ditentukan oleh kecepatan pencampuran turbulen. Pada saat yang sama, pencampuran makro dan pencampuran mikro dibedakan. Proses pencampuran turbulen melibatkan penghancuran sekuensial gas: menjadi volume yang semakin kecil dan mencampurkannya bersama-sama. Pada tahap terakhir, pencampuran molekuler terakhir dilakukan dengan difusi molekuler, laju peningkatan dengan menurunnya skala fragmentasi. Setelah selesai pencampuran makro, laju pembakaran ditentukan oleh proses pencampuran mikro di dalam volume kecil bahan bakar dan udara. Pembakaran heterogen terjadi pada antarmuka. Dalam hal ini, salah satu zat yang bereaksi dalam keadaan terkondensasi, yang lain (biasanya oksigen atmosfer) berasal dari difusi fase gas. Prasyarat untuk pembakaran heterogen adalah titik didih yang sangat tinggi (atau dekomposisi) fase terkondensasi. Jika kondisi ini tidak terpenuhi, pembakaran didahului dengan penguapan atau penguraian. Dari permukaan, aliran uap atau produk penguraian gas memasuki zona pembakaran, dan pembakaran terjadi dalam fase gas. Pembakaran tersebut dapat dikaitkan dengan difusi kuasi-heterogen, tetapi tidak sepenuhnya heterogen, karena proses pembakaran tidak lagi terjadi pada batas fase. Pengembangan pembakaran tersebut dilakukan karena aliran panas dari nyala api ke permukaan material, yang memberikan penguapan lebih lanjut atau dekomposisi dan aliran bahan bakar ke zona pembakaran. Dalam situasi seperti itu, suatu kasus campuran muncul ketika reaksi pembakaran sebagian berjalan secara heterogen - pada permukaan fase terkondensasi, sebagian secara homogen - dalam volume campuran gas. Contoh pembakaran heterogen adalah pembakaran batubara dan arang. Ketika zat-zat ini terbakar, reaksi dari dua jenis terjadi. Beberapa varietas batubara mengeluarkan komponen yang mudah menguap ketika dipanaskan. Pembakaran batubara semacam itu didahului oleh dekomposisi termal parsialnya dengan melepaskan hidrokarbon gas dan hidrogen, yang terbakar dalam fase gas. Selain itu, ketika karbon murni dibakar, karbon monoksida CO dapat terbentuk, yang terbakar dalam volume. Dengan kelebihan udara yang cukup dan suhu tinggi dari permukaan batubara, reaksi volume berlangsung sangat dekat dengan permukaan sehingga, dengan perkiraan tertentu, itu memberikan alasan untuk mempertimbangkan proses semacam itu heterogen. Contoh pembakaran yang benar-benar heterogen adalah pembakaran logam non-volatil yang tahan api. Proses-proses ini dapat menjadi rumit dengan pembentukan oksida yang menutupi permukaan yang terbakar dan mencegah kontak dengan oksigen. Dengan perbedaan besar dalam sifat fisikokimia antara logam dan oksida selama pembakaran, film oksida retak dan oksigen diizinkan masuk ke zona pembakaran. |
Populer:
Baru
- Bagaimana menghapus wallpaper vinil lama dari dinding dengan benar dan cepat Bagaimana menghapus wallpaper vinil lama dari dinding
- Bagaimana cara membuat kemiringan atap dari panel sandwich?
- Bagaimana cara menutupi strobe wiring?
- Cara membuat lokomotif uap dan transportasi darat lainnya melakukannya sendiri
- Mangkok minum itik untuk Anda sendiri: fitur pembuatan
- Tata ruang apartemen dalam serangkaian kubus 2
- Lakukan sendiri dari hal-hal yang tidak perlu: pekarangan, kebun, kebun dapur
- Konstruksi kapal motor aluminium yang dilas "ajaib" Konstruksi kapal aluminium
- Pom bensin rumah
- Drywall Carrier: Sederhana dan Nyaman


 dalam hal ini, ketika campuran yang mudah terbakar dinyalakan di beberapa titik, bagian depan nyala bergerak dari produk pembakaran ke campuran segar. Dengan demikian, nyala api selama pembakaran kinetik paling sering tidak stabil (Gbr. 19).
dalam hal ini, ketika campuran yang mudah terbakar dinyalakan di beberapa titik, bagian depan nyala bergerak dari produk pembakaran ke campuran segar. Dengan demikian, nyala api selama pembakaran kinetik paling sering tidak stabil (Gbr. 19). ,
(4.1)
,
(4.1)